Эффективная терапия любого заболевания возможна только после постановки точного диагноза. Лечебная тактика для каждой патологии определяется индивидуально: врач обязательно будет учитывать массу факторов, влияющих на исход терапевтических процедур. Контроль излеченности проводится в указанные доктором сроки – необходимо прислушаться к врачу, аккуратно и точно выполняя назначения специалиста.
Лечение включает различные варианты и методы воздействия на организм больного человека
Факторы, влияющие на выбор тактики терапии
По результатам полноценного обследования врач поставит диагноз, являющийся отправной точкой для назначения эффективного лечения. Без понимания, с чем надо бороться и какова природа заболевания, лучше не начинать никаких лечебных процедур. Для выбора терапии важными являются следующие факторы:
- возраст и пол пациента;
- точный диагноз;
- риск для жизни;
- сопутствующие виды хронических болезней;
- переносимость лекарственных средств;
- наличие определенных физиологических состояний.
При серьезной патологии лечебная тактика всегда индивидуальна: даже при одинаковом диагнозе у разных людей могут быть разные терапевтические подходы. Иногда у больного человека может быть выбор – врач предложит варианты лечения, но чаще доктор определяет, что делать и какие методы будут наиболее эффективны.
Лечебная тактика – варианты и методы
Лечение – это всегда творческий процесс: даже при наличии стандартов терапии, определяемых инструкциями и министерскими приказами, лечебная тактика у каждого врача индивидуальна, что объясняется следующими факторами:
- собственный опыт;
- знания;
- интуиция;
- клиническое мышление.
Последний фактор наиболее значим – лечить надо не болезнь, а человека. В организме все взаимосвязано, поэтому на любом этапе лечебно-диагностического процесса опытный и думающий доктор будет смотреть в целом на больного человека и искать патологию, являющуюся первопричиной заболевания (если смотреть только на имеющиеся сейчас симптомы, то можно пропустить массу сопутствующих проблем и скрытых болезней).
Лечебная тактика предполагает использование следующих основных вариантов терапии:
- Хирургические;
- Медикаментозные;
- Физиотерапевтические;
- Санаторно-курортные.

Хирургическое вмешательство – один из основных методов лечения
Применяется в тех случаях, когда таблетки и уколы не смогут изменить ситуацию: основной постулат – лучшая операция та, которая не сделана. Если имеется возможность вылечить без частичного или полного удаления органа или ткани, то надо обязательно использовать этот шанс. Однако большое количество болезней вылечить без операции невозможно (онкология, острая хирургическая патология, врожденные пороки). подразумевает использование следующих методов лечения:
- прием внутрь таблеток, микстур, порошков;
- введение свечей ректально или вагинально;
- инъекции лекарственных растворов;
- закапывание глазных капель или впрыскивание спрея в нос.
Важными лечебными факторами являются доза лекарства и кратность введения – в каждом конкретном случае надо строго выполнять назначения, предписанные доктором.
Физиотерапия и санаторно-курортное лечение – это реабилитация и восстановительная терапия после стихания острого процесса.
Исход болезни
Часть заболеваний вылечить невозможно, иногда от болезни можно избавить временно, но чаще всего врач может полностью вылечить патологию. Эффективная лечебная тактика подразумевает следующие исходы терапии любого заболевания:
- выздоровление;
- временное улучшение;
- переход в хроническую форму;
- отсутствие эффекта;
- ухудшение.
В двух последних случаях причину надо искать в диагнозе: или он неточен, или появились дополнительные отягчающие моменты. После дообследования и уточнения причин неэффективности терапии проводится следующий курс лечения.
Критерии излечения
О полном или частичном выздоровлении можно говорить по следующим критериям:
- отсутствие жалоб;
- улучшение общего состояния;
- исчезновение симптомов;
- нормализация показателей в анализах;
- отсутствие проблем при контрольном обследовании.
Правильная лечебная тактика, подобранная опытным доктором с учетом диагноза и при тщательной диагностической оценке организма больного человека, поможет справиться с большинством заболеваний, возникающих у людей. Важно вовремя обращаться к специалисту, чтобы выявить патологию на ранних этапах возникновения, что особенно актуально при онкологии.
Г.И. Воробьев, Л.А. Благодарный, Ю.А. Шелыгин
Государственный научный центр колопроктологии Минздрава РФ и кафедра
колопроктологии
РМАПО (дир. и зав. кафедрой - акад. РАМН, проф. Г.И. Воробьев),
г. Москва
Геморрой все еще остается наиболее частым заболеванием человека. Его распространенность достаточно высока и составляет 118-120 человек на 1000 взрослого населения, а удельный вес в структуре колопроктологических заболеваний колеблется от 34 до 41%.
Патогенез
Работами Л.Л. Капуллера, В.Л. Ривкина (1976); И.Г. Дацун, Е.П. Мельман (1986); Л. Шафик, М. Мохи-эль-Дин (1995); F.Stelzner (1963), W.Thompson (1976); Р. Naas и соавт. (1984) установлено, что в основе геморроя лежит патология кавернозных образований подслизистого слоя дистальной части прямой кишки, заложенных в процессе нормального эмбриогенеза.
На основании клинических данных, а также результатов патоморфологических и физиологических исследований мы пришли к заключению, что ведущими в патогенезе геморроя являются гемодинамический и мышечно-дистрофический факторы. В основе первого лежит дисфункция сосудов, приводящая к усиленному притоку артериальной крови и уменьшению оттока по кавернозным венам, что приводит к увеличению размеров кавернозных телец и развитию геморроидальных узлов.
Вторым ведущим фактором является развитие дистрофических процессов в продольной мышце подслизистого слоя прямой кишки и связке Паркса, расположенной в межсфинктерном пространстве анального канала. На наш взгляд, эти структуры образуют фиброзно-мышечный каркас внутренних геморроидальных узлов и удерживают их в анальном канале выше аноректальной линии. Под действием неблагоприятных факторов происходит увеличение размеров геморроидальных узлов, их смещение в дистальном направлении и в конечном итоге выпадение из анального канала. В основном эти нарушения происходят в группах высокого риска, к которым относятся люди, занимающиеся тяжелым физическим трудом, страдающие запорами, сидячих профессий.
Клиническая картина
Для геморроя традиционно характерны два основных симптома - кровотечение (51%) и выпадение узлов из анального канала (37%). При этом заболевании также отмечаются такие симптомы, как анальный зуд (9%), чувство дискомфорта в анальном канале (5%), выделения слизи (2%). Под маской геморроя, особенно при выделении крови из прямой кишки, нередко протекают такие заболевания, как полипы и колоректальный рак. Поэтому при любых проявлениях кишечного дискомфорта и особенно при выделении крови из прямой кишки необходимо проведение ее пальцевого исследования, ректоскопии, колоно- или ирригоскопии.
В зависимости от степени увеличения геморроидальных узлов и развития дистрофических процессов в удерживающем фиброзно-мышечном каркасе мы выделяем четыре стадии заболевания. Для первой стадии характерным признаком является выделение крови из анального канала без выпадения геморроидальных узлов. Вторая стадия характеризуется выпадением геморроидальных узлов с самостоятельным вправлением в анальный канал (с кровотечением или без него). Отличительной особенностью третьей стадии является необходимость ручного вправления геморроидальных узлов при выпадении (с кровотечением или без него). Четвертая стадия характеризуется постоянным выпадением узлов и невозможностью их вправления в анальный канал (с кровотечением или без него). По нашему мнению, эта классификация дает возможность в практической работе выбрать адекватный метод лечения.
Геморрой проявляется не только в виде хронического процесса, но и в остром приступе заболевания. Острый геморрой по клиническому течению мы разделяем на три стадии:
1. Тромбоз наружных и внутренних геморроидальных узлов без воспалительного процесса.
2. Тромбоз, осложненный воспалением геморроидальных узлов.
3. Тромбоз геморроидальных узлов, осложненный воспалением подкожной клетчатки и перианальной кожи. Основой для развития острого геморроя является тромбоз геморроидальных узлов. Воспалительный процесс, развивающийся в узле и окружающих тканях, является его следствием.
Безусловно, при остром геморрое показано консервативное лечение, но следует отметить, что его профилактика прежде всего заключается в нормализации деятельности пищеварительного тракта, лечении синдрома раздраженной толстой кишки, который встречается более чем у половины пациентов, заболевших геморроем.
Мы назначаем ферментные препараты, средства, влияющие на флору и перистальтику тонкой и толстой кишки, гидрофильные коллоиды, или, как их еще называют, пищевые волокна, на фоне регулярного потребления жидкости. В качестве их источника в нашей стране традиционно применяют отруби пшеничные, морскую капусту и льняное семя в их природном виде или в форме фармакологических препаратов. За рубежом чаще применяют семена и шелуху подорожника и льняное семя в виде таких препаратов, как агиолакс, файберлакс, нутриклинз и др., обладающих высокой водоудерживающей способностью. В нашу задачу не входит анализ медикаментозной терапии синдрома раздраженной толстой кишки. Однако регуляция консистенции кишечного содержимого и его транзита по толстой кишке является непременным условием не только профилактики, но и успешного лечения геморроя.
Консервативное лечение
Показанием для консервативного лечения являются начальные стадии хронического геморроя и острое течение заболевания. Этот вид терапии складывался из общего и местного лечения. Местное лечение направлено на ликвидацию болевого синдрома, тромбоза или воспаления геморроидальных узлов, а также кровотечения. Основой общего лечения являлось применение флеботропных препаратов, влияющих на повышение тонуса вен, улучшение микроциркуляции в кавернозных тельцах и нормализацию в них кровотока. В эту группу входит много препаратов, но, по нашему мнению, наиболее действенным в этой группе является детралекс. Лечение этим препаратом проведено 120 пациентам с острым геморроем. По сравнению с группой пациентов, принимающих плацебо, болевой синдром в основной группе уменьшился в 83% случаев. Выпадение узлов уменьшилось у 81% человек, а кровоточивость геморроидальных узлов - у 91 %. В этой же группе почти в 2 раза отмечено уменьшение частоты и количества приема ненаркотических анальгетиков. У 98% пролеченных пациентов после проведения подобного лечения отмечено стихание воспалительных явлений, а частота ежегодных обострений уменьшилась в 2,2 раза. Лечение этими препаратами позволяет более чем в 2 раза уменьшить продолжительность обострений и в 1,5 раза снизить среднюю тяжесть обострении.
При выборе местного лечения острого геморроя необходимо учитывать превалирование одного из симптомов - боль, тромбоз, распространенность воспалительного процесса и наличие деструктивного компонента. При кровотечении следует четко оценить величину кровопотери, его активность и выраженность постгеморрагической анемии.
Болевой синдром при геморрое чаще связан с ущемлением тромбированного геморроидального узла или возникновением острой анальной трещины. Поэтому для устранения болевого синдрома показано применение ненаркотических анальгетиков и местных комбинированных обезболивающих препаратов. Для местной терапии геморроя мы применяем такие препараты, как ауробин, ульрапрокт, проктогливенол и др. Из этой группы выделяется своей эффективностью новый препарат нефлюан, содержащий высокую концентрацию лидокаина и неомицина.
Тромбоз геморроидальных узлов является показанием к применению антикоагулянтов местного действия. К этой группе препаратов относятся гепариновая и троксевазиновая мази, амбенат, гепатромбин Г.
В качестве препарата для местного лечения геморроя особенно зарекомендовал себя гепатромбин Г. Препарат состоит из трех компонентов и содержит прямой антикоагулянт гепарин, глюкокортикоидный гормон преднизолон и анестетик полидоканол. Каждый компонент препарата оказывает свое благотворное действие при тромбозе геморроидальных узлов. Гепарин, нарушая переход протромбина в тромбин, при местном применении препятствует образованию тромбов, кроме того, он обладает противовоспалительным и противоотечным действием. Преднизолон оказывает мощное противовоспалительное действие при местном применении, уменьшая отек, зуд и чувство жжения. Полидоканол оказывает местное анестезирующее действие, по силе равное лидокаину, но в отличие от последнего полидоканол реже вызывает аллергические реакции.
В 70-80% наблюдений тромбоз геморроидальных узлов осложняется их воспалением с переходом на подкожную клетчатку и перианальную область. При этом указанные препараты применяются в сочетании с водорастворимыми мазями, обладающими мощным противовоспалительным действием. К ним относятся левасин, левомеколь, мафинид.
Кровотечение является одним из основных симптомов геморроя. Непрекращающееся кровотечение в течение 1 ч является признаком острого процесса. Для его устранения можно применять свечи, содержащие адреналин. Помимо этого применяют такие местные гемостатические материалы, как адроксон, берипласт, тахикомб, спонгостан, состоящие из фибриногена и тромбина. При введении в анальный канал они рассасываются, образуя фибриновую пленку. Ряд авторов (М.А. Камалов, 1988; А.М. Коплатадзе и соавт., 1989; В.В. Ставицкий и соавт., 1993; К. Еu и соавт., 1994) при остром геморрое рекомендуют проводить хирургическое вмешательство в объеме геморроидэктомии. По нашему мнению, это вмешательство возможно производить либо до развития воспалительного компонента, в первые часы после начала заболевания, либо в отсроченном порядке. В ГНЦ колопроктологии после проведения активной противовоспалительной терапии через 5-7 дней после стихания воспалительного процесса 690 пациентам проведена геморроидэктомия. У 97% пациентов получен хороший результат. При этом не отмечено увеличение числа послеоперационных осложнений.
Малоинвазивные методы лечения геморроя
В последние годы в связи с развитием новых технологий в медицинской промышленности, созданием новых препаратов все большее распространение получают так называемые малоинвазивные способы лечения геморроя, вполне пригодные для применения в амбулаторных условиях. К ним относятся склеротерапия, инфракрасная фотокоагуляция геморроидальных узлов, лигирование латексными кольцами, электрокоагуляция и др.
В большинстве стран Америки и Европы типичную геморроидэктомию в настоящее время выполняют лишь у 17-21% пациентов, а у остальных применяют малоинвазивные способы лечения (A. Neiger, 1992; М. Cormann и соавт., 1994; Н. Abcarion и соавт., 1994). В то же время в России наиболее распространенным способом лечения является геморроидэктомия, выполняемая у 75% пациентов, а малоинвазивные способы применяют лишь у 3%.
Склерозирующее лечение и инфракрасную фотокоагуляцию мы проводили у больных с начальными стадиями геморроя с преобладанием симптомов кровотечения. Лигирование геморроидальных узлов латексными кольцами мы проводили в поздних стадиях геморроя, для которых основным симптомом является выпадение геморроидальных узлов. Противопоказанием для проведения малоинвазивных способов лечения является тромбоз геморроидальных узлов, острый и хронический парапроктит, анальная трещина и другие воспалительные заболевания анального канала и промежности.
Эти виды лечения мы провели 870 пациентам. Среди них женщин было 42%, мужчин - 58%. Длительность заболевания варьировала от 1,5 до 23 лет и в среднем составила 7,5±0,8 лет. Возраст пациентов колебался от 24 до 78 лет и в среднем составил 46,3±2,1 года. Большей части (84,7%) пациентов со второй и третьей стадией заболевания проведены малоинвазивные способы лечения.
В начальных стадиях геморроя показано применение инфракрасной фотокоагуляции геморроидальных узлов. Для фотокоагуляции мы применяли аппарат «Инфратон МВВ-АТ» (Германия), состоящий из инфракрасного фотокоагулятора и жесткого кварцевого световода. Сфокусированный отражателем световой поток от галогеновой лампы направляется в световод. Через аноскоп наконечник световода подводится к геморроидальному узлу до контакта с ним. Тепловой поток энергии, проходящий через световод, коагулирует поверхность геморроидального узла. Такую коагуляцию проводят в 2-6 местах ближе к его ножке. В результате воздействия теплового потока происходит коагуляция стенки сосудистой ножки геморроидального узла с последующим его склерозом и облитерацией просвета.
Результаты лечения оценивали как хорошие, удовлетворительные и неудовлетворительные. Критерием хорошего результата мы считали прекращение кровотечения, выпадения геморроидальных узлов и обострения заболевания. Удовлетворительным результатом считали уменьшение размеров узла, сокращение частоты обострения геморроя и прекращение кровотечения. Под неудовлетворительным результатом мы подразумевали кратковременный эффект и ранний рецидив заболевания.
Инфракрасная фотокоагуляция применена у 120 пациентов с первой - второй стадией геморроя с преобладанием кровотечения. Противопоказанием для этого метода является тромбоз геморроидальных узлов, а также воспалительные заболевания анального канала и промежности. У 78,3% получен хороший результат. У 2% пациентов после коагуляции отмечен болевой синдром и тромбоз геморроидальных узлов, который был купирован консервативными мероприятиями (ненаркотические анальгетики, противовоспалительные свечи, физиопроцедуры).
Склерозирующее лечение геморроя использовано у 190 человек. В качестве флебосклерозирующих препаратов мы применяли 3% растворы тромбовара и этоксисклерола. По механизму действия они являются детергентами, т.е. после их введения в просвет геморроидального узла происходит денатурация белков оболочки артериовенозных шунтов, тромбоз узла с последующей облитерацией его просвета.
Склерозирующее лечение геморроя выполнял врач-колопроктолог в амбулаторных и стационарных условиях. Суть метода заключается в том, что шприцем с двумя проушинами и длинной иглой с ограничителем у ее острого края при помощи аноскопа с осветителем в просвет геморроидального узла ближе к его ножке вводят 1,5-2 мл склерозирующего препарата. Одновременно введение препарата возможно не более чем в два геморроидальных узла, так как при введении большего количества препарата развивается выраженный болевой синдром. При необходимости повторный сеанс проводят не ранее чем через 12-14 дней после стихания воспалительного процесса.
При первой и второй стадии заболевания после склеротерапии число хороших результатов достигло 85-71%. При поздних стадиях хорошие результаты получены у 52-26% пациентов. Соответственно в третьей и четвертой стадии неудовлетворительные результаты получены 31-62% наблюдений.
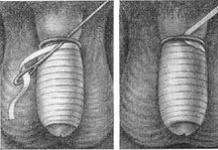
Достаточно эффективным малоинвазивным способом лечения геморроя является лигирование геморроидальных узлов латексными кольцами. Этот вид лечения производят в основном при поздних стадиях заболевания. Методика дотирования заключается в том, что через аноскоп с осветителем при помощи вакуумного или механического лигатора Karl Storz, Германия) набрасывают латексное кольцо на внутренний геморроидальный узел, который отторгается вместе с латексной лигатурой на 7-9-й день. На месте отторжения геморроидального узла формируется его культя, покрытая соединительной тканью.
Мы провели лигирование внутренних геморроидальных узлов латексными кольцами у 340 пациентов. Все процедуры проведены амбулаторно. Результаты лечения прослежены в течение 2 лет у 320 (94,196) пациентов. Установлено, что в 87,7% произошло полное купирование всех симптомов заболевания. При второй стадии лигирование проведено у 167 (49,3) пациентов с хорошими результатами у 151 (90,4%) человека. При третьей и четвертой стадии заболевания хорошие результаты получены в 87,9 и 84,5 случаев соответственно.
Таким образом, правильно выбранные показания для лигирования внутренних геморроидальных узлов позволили получить хороший результат лечения у 87,7% наблюдений.
Оперативное лечение
В настоящее время в нашей стране и за рубежом большая часть колопроктологов при геморрое выполняет операцию, направленную на иссечение трех геморроидальных узлов (А.Н. Рыжих, 1968; ВД. Федоров и соавт, 1984; ВЛ. Ривкин и соавт., 1994; А. Neiger, 1990; М. Cormann, 1994; М. Pescatori, 1995). Эта операция, предложенная Миллиганом и Морганом (1934) в 30-х годах нашего столетия, продолжает модифицироваться до настоящего времени. В последние годы в нашей стране и за рубежом применяют в основном три разновидности операций. Первая - это закрытая геморроидэктомия с восстановлением слизистой оболочки анального канала кетгутовыми швами. Этот вид оперативного вмешательства мы в основном применяем при геморрое 3-4-й стадии при отсутствии четких границ между наружными и внутренними геморроидальными узлами. Вторую методику - открытую геморроидэктомию, при которой наружные и внутренние геморроидальные узлы удаляют единым блоком при помощи коагуляционного ножа с перевязкой ножки узла кетгутовой нитью и оставлением открытой раны анального канала - выполняют у пациентов с теми же стадиями заболевания, осложненных анальной трещиной или парапроктитом. Третьей разновидностью является подслизистая геморроидэктомия, выполняемая по типу пластической операции А.Parks (1956). В отечественной литературе мы вообще не встретили работ, посвященных использованию этого способа лечения геморроя.
Нами разработана модификация подслизистой геморроидэктомии. Преимущества этой операции заключаются в том, что слизистая оболочка анального канала не иссекается вместе с геморроидальным узлом, а рассекается дугообразными разрезами, после чего из подслизистого слоя острым путем при помощи коагулятора выделяют узел, перевязывают его ножку, узел отсекают, оставляя культю удаленного узла в подслизистом слое. Дугообразные разрезы позволяют без деформации полностью восстановить слизистую оболочку анального канала и укрыть ею культю узла. Особенностью этой операции является кропотливость вмешательства и повышенная кровоточивость тканей. Поэтому мы выполняем эту операцию только с высокочастотным электрокоагулятором с игольчатыми и шаровидными электродами.
Каждая операция имеет свои преимущества и недостатки. Так, закрытая геморроидэктомия привлекает отработанностью техники, простотой и надежностью. В то же время после подобной операции у большинства оперированных пациентов отмечается выраженный послеоперационный болевой синдром, регистрируется большое число дизурических расстройств. Преимуществами открытой геморроидэктомии является простота выполнения операции, невыраженный послеоперационный болевой синдром. Недостатки этой методики - длительное заживление и кровоточивость раны. Сложность технического исполнения подслизистой геморроидэктомии, длительность и кропотливость самой операции компенсируется кратковременным и невыраженным болевым синдромом, незначительным числом дизурических расстройств и достаточно кратковременным периодом реабилитации этих больных.
В последние годы в печати появились сообщения о применении циркулярных степлеров для выполнения операции по поводу геморроя. Впервые эта операция предложена итальянским профессором Лонго. Ее суть заключается в циркулярном пересечении слизистой оболочки прямой кишки и сосудов, питающих геморроидальные узлы, ликвидации выпадения. В России только начинает накапливаться опыт этих операций.
Лечение геморроя в зависимости от стадии заболевания
У пациентов с первой стадией показаны: консервативное лечение с флеботропными препаратами, а именно детралексом, инфракрасная фотокоагуляция и склеротерапия.
При второй стадии возможно проводить инфракрасную фотокоагуляцию, склеротерапию, лигирование геморроидальных узлов латексными кольцами и консервативную терапию.
При третьей стадии заболевания лучше проводить лигирование или при отсутствии границ между наружными и внутренними геморроидальными узлами - геморроидэктомия. При противопоказаниях к хирургическому вмешательству следует проводить лигирование геморроидальных узлов латексными кольцами или консервативную терапию в качестве поддерживающего лечения.
Отметим, что если консервативное лечение острого и хронического геморроя может осуществляться врачами общей практики, то малоинвазивные методы должны выполняться только врачом-колопроктологом в амбулаторных, реже в стационарных условиях. Хирургическое вмешательство - геморроидэктомия - также должно производиться в специализированных стационарах.
Таким образом, выбор метода лечения геморроя в зависимости от его стадии и выраженности симптоматики, применение консервативной терапии, малоинвазивных методов как в самостоятельном исполнении, так и в комбинации друг с другом или с хирургическими способами позволяют достичь хороших результатов у 88,9% пациентов.
Литература :
1.Аминев А.М. Руководство по проктологии. Куйбышев. Книжное издательство. 1971; 2: 31- 78.
2. Генри М, Свош М. Колопроктология и тазовое дно. М, Медицина, 1988; 98-117.
3..Дацун И.Г., Мельман Е.Л. Роль гломусных шунтов аноректальных кавернозных телец в механизме развития геморроя. Арх. патологии. 1992,54(8): 28-31.
4. Капуллер Л.Л, Ривкин В.Л. Геморрой: патогенез, клиника, лечение. М Медицина, 1976; 276.
5. Коплатадзе А.М., Бондарев Ю.А., Комолое М.А. Хирургические методы лечения больных острым тромбозом геморроидальных узлов. Вести, хирургии, 1989; 143(11): 140-3.
6. Ривкин В.Л., Капуллер Л.Л, Дульцев Ю.В. Геморрой и другие заболевания анального канала и промежности. М, 1994; 128.
7. Рыжих А.Н. Атлас операций на прямой и толстой кишках. М, Медицина, 1968; 106-122.
8. Федоров В.Д., Дульцев Ю.В. Проктология. X, Медицина, 1984; 72-84.
9. Abcarion H, Alexander-Williams J, Chritiansen J. Benign anorectal disease definition characterition andanalisis of treatment. Amer] Gastroenterol 1994; 89(8): 182-90.
10. Connann M. Anus (S- rectum surgery. USA, Philadelphia, Haemorrhoids, 1994; 54-115.
11. Neiger A Atlas of practical proctology. Toronto, 1990; 29-7 4.
12. Parks AG. The surgical treatment ofhaemorrgoids. Brit] Surg 1956; 43: 37-46.
13. SteIznerF, StaubesandJ, MachliedtH. dos corpus cavemosum rectidie grunebage der innerin haemorrhoider. Langenbecks-Arch-Klin-Chir 1963; 299: 302-312.
14. Thomson W.H.F. The nature of haemorrhoids. BrJ Surg 1975;62: 542-52.
Проблема травматического сдавления головного мозга (ТСГМ) постоянно находится в центре внимания исследователей всего мира не только потому, что число неблагоприятных исходов до сих пор остается высоким (до 30% - в специализированных и до 80% - в неспециализированных стационарах), но и благодаря появлению новых методов диагностики, хирургического и консервативного лечения и коррекции.
ТСГМ (внутричерепные гематомы и гидромы, очаги размозжения и ушиба мозга, вдавленные переломы, пневмоцефалия, множественные субстраты компрессии), по нашим данным, встречается у 15% больных с черепно-мозговыми повреждениями. Оно характеризуется жизненно-опасным нарастанием нарушений витальных функций и неврологического дефицита, требует экстренной диагностики и решения вопроса об оперативном вмешательстве.
Клиническая картина
Клиническая картина ТСГМ многообразна, динамична и зависит от ряда факторов:
- локализации и степени ушиба мозга, на фоне которого формируется гематома;
- локализации и вида компримирующего мозг субстрата;
- возраста пациента;
- наличия сопутствующих внечерепных повреждений и соматических заболеваний.
Она складывается из различной выраженности общемозговых (появление или усугубление нарушений сознания, усиление головных болей, повторная рвота, психомоторное возбуждение), очаговых (появление или усугубление гемипареза, одностороннего мидриаза, фокальных эпилептических припадков и др.) и стволовых (появление брадикардии, повышение АД, ограничение взора вверх, патологические стопные знаки, диссоциация сухожильных рефлексов и менингеальных симптомов по оси тела и др.) симптомов.
Классический вариант клиники ТСГМ встречается относительно редко (при оболочечных гематомах, чаще эпидуральных, формирующихся на фоне ушиба мозга легкой или средней степени тяжести).
Для него характерна трехфазность в динамике состояния сознания. После черепно-мозговой травмы (ЧМТ) наступает утрата сознания (обычно на 10-30 мин), затем происходит его восстановление - полное или частичное (развернутый или стертый светлый промежуток), длящееся от нескольких минут до нескольких дней, после чего наступает вторичное расстройство сознания вплоть до комы, если не устраняется сдавление мозга.
Чаще встречается вариант клинического течения ТСГМ без светлого промежутка. Это бывает в тех случаях, когда сдавление мозга формируется на фоне его тяжелого ушиба, алкогольной интоксикации, при субдуральных гематомах, очагах размозжения или множественных субстратах компрессии, которые, по нашим данным, наблюдаются в половине случаев ТСГМ.
Необходимо иметь в виду, что иногда не удается выявить факт утраты сознания после травмы, хотя клиника компрессии мозга выражена. Это обычно бывает при хронических субдуральных гематомах, которые постепенно накапливаются, достигая значительного объема (до 150- 200 мл). Причина тому- незначительная травма головы, которой пациент не придал значения, и длительное компенсированное состояние больного.
Варианты клинической картины ТСГМ характерны для всех форм компрессии: вид компримирующего субстрата, его локализация и уровень компенсации мозговых функций влияют на соотношение выраженности общемозговых, очаговых и стволовых симптомов у каждого конкретного пострадавшего.
- при ограниченных вдавленных переломах свода черепа в клинической картине доминируют очаговые неврологические симптомы;
- для субдуральных гидром и пневмоцефалии характерны эпилептические припадки;
- при обширных острых субдуральных гематомах, очагах размозжения мозга обычно наблюдаются глубокая утрата сознания, грубые очаговые и стволовые симптомы;
- при гематомах, локализующихся в задней черепной ямке, рано нарастает окклюзия ликворных путей и внутричерепная гипертензия, выявляются мозжечковые симптомы, нарушение глотания, стволовые знаки.
Компьютерная (КТ) и магнитно-резонансная томография (МРТ), без преувеличения, произвели революцию в диагностике ТСГМ, в частности тяжелой ЧМТ. Однако эти высокоинформативные методы визуализации не исключают необходимости исследования и анализа динамики клинической картины, что обусловлено следующими факторами:
- врачи скорой медицинской помощи должны в течение короткого времени оценить состояние больного и постараться клинически поставить диагноз;
- к сожалению, до настоящего времени не все лечебные учреждения, особенно районного звена, располагают КТ или МРТ, а в некоторых даже крупных центрах не организовано круглосуточное их функционирование;
- нередко критическое состояние больного не позволяет выполнить КТ/МРТ.
Первичные повреждения головного мозга при ЧМТ: ушибы легкой, средней и тяжелой степени, размозжение мозгового вещества, диффузное аксональное повреждение - могут в значительной степени усугубляться вторичными повреждениями, которые нередко становятся доминирующими, определяющими клиническую картину и прогноз.
Они возникают вследствие развертывания каскада сосудистых и биохимических нарушений, запускаемых первичной травмой. Особое значение имеют местная циркуляторная гипоксия, местное токсическое воздействие продуктов распада тканей (эндотоксемия). Исход в значительной степени зависит от того, насколько удается предупредить или свести к минимуму вторичные повреждения мозга.
Вторичные повреждения головного мозга делятся на интракраниальные (гематомы, отек и набухание мозга, гидроцефалия) и экстракраниальные (гипо- или гиперосмолярность, артериальная гипо- или гипертензия, анемия, гипо- или гиперкапния, гипертермия). Эти повреждения в конечном итоге способствуют развитию гипоксии, внутричерепной гипертензии, отеку, дислокации и вклинению мозга.
Особое место в патогенезе, клинической манифестации и исходе ТСГМ принадлежит нарушениям мозгового кровообращения. Практически при всех тяжелых ушибах и сдавлении головного мозга развивается ишемия той или иной степени выраженности. Причинами ее могут быть снижение мозгового кровотока в бассейне пораженной артерии и нарастание гипоксии, недостаток кислорода в крови вследствие респираторных расстройств и дисбаланса между доставкой, потребностью и потреблением кислорода мозгом.
Факторами риска развития ишемии мозга являются: сдавление артериальных и венозных сосудов в зоне ушиба и компрессии мозга, спазм сосудов при субарахноидальном кровоизлиянии, гипоперфузия из-за высокого внутричерепного давления (ВЧД), а также анемия, длительная артериальная гипотензия при сочетанной и множественной травмах.
В зависимости от превалирования той или иной причины ишемия может быть краевой, чаще вследствие дислокации и транстенториального вклинения мозга, и локальной, возникающей непосредственно в зоне сдавления мозга. Диффузные ишемические нарушения связаны с распространенным вазоспазмом или длительно не устраненной компрессией мозга. Ишемия значительно усугубляет состояние пострадавшего и трудно поддается терапии.
- Пострадавший с тяжелой ЧМТ - это больной с быстро прогрессирующими нарушениями мозгового кровообращения. Все лечебные мероприятия должны предусматривать меры их коррекции и профилактику вторичных дисгемий. Затягивание с операцией при наличии внутричерепной гематомы чревато не только дислокацией мозга, но и развитием необратимых ишемических некрозов в ткани мозга, приводящих к смерти пострадавшего или к значительному неврологическому дефициту.
- Важен сам факт динамичности мозгового кровотока во время оперативных вмешательств. Неадекватная анестезия, грубые манипуляции на мозге неминуемо приведут к усугублению сосудистых расстройств; исходное состояние мозгового кровотока уже характеризуется как неустойчивое. При вмешательствах на фоне массивного субарахноидального кровоизлияния необходимы меры предосторожности с целью предотвращения усугубления ангиоспазма после операции.
- Обосновано назначение после операции терапии, способствующей реперфузии ишемизированных зон и предупреждению расширения зон некроза, профилактике отсроченного формирования внутричерепных гематом.
Исследованиями, прежде всего сотрудников Российского нейрохирургического института им. А.Л. Поленова, показано, что внутричерепные гематомы формируются в первые три часа после травмы. Однако динамическая КТ позволила внести коррективы в это утверждение. Оказалось, что часть из них может формироваться спустя длительное время (несколько часов и даже суток).
Этот факт очень важен, поскольку необнаружение гематомы в первые часы после травмы, в том числе при КТ-, МРТ- исследовании, не означает, что диагностическая задача однозначно решена. За больным следует установить динамическое клиническое наблюдение и ежедневный КТ- контроль, по крайней мере в течение недели.
Отсроченные гематомы могут возникать при отрыве тромба, вследствие расплавления очага ушиба- размозжения, а также в результате массивной неконтролируемой дегидратационной терапии, когда резко спадает отек мозга и освобождающееся подоболочечное пространство заполняется кровью.
Отсроченное по времени формирование внутричерепных гематом необходимо отличать от формирования гематом, возникающих вследствие вторичной травмы мозга. При этом происходит расширение зоны первичного некроза с вовлечением в патологический процесс исходно интактных участков мозга.
Внутримозговые геморрагии могут возникать как на стороне удаленной гематомы или очага размозжения, так и на противоположной стороне. Этому способствуют внутрибольничная транспортировка, судорожный синдром, гипертермия, анемия, гипоксия, неадекватная интенсивная терапия и анестезиологическое пособие, а также травматичное оперативное вмешательство.
Вторичный инсульт всегда опаснее, так как протекает на фоне повышенной уязвимости мозговой ткани ко всем видам агрессии.
Лечебная тактика
В Нижегородском нейрохирургическом центре на лечении ежегодно находится около 200 больных с ТСГМ. Большой опыт по оказанию помощи таким пострадавшим, целенаправленное изучение проблемы в течение многих лет позволили разработать алгоритмы действий в зависимости от вида и локализации компримирующего субстрата, уровня компенсации мозговых и общеорганизменных функций, динамики данных нейровизуализации (КТ, МРТ).
Нами выделено 5 вариантов хирургической тактики: немедленная операция (1,3%), экстренная операция (79%), отсроченная операция (4,5%), плановая операция (10,2%), консервативное лечение (5%).
Немедленная операция показана при бурно, буквально за считанные минуты, нарастающих симптомах дислокации, что проявляется обычно глубоким расстройством сознания, предельной анизокорией, расстройствами дыхания. Нет времени не только на дополнительные инструментальные методы диагностики, но нередко даже на полноценную обработку операционного поля.
Разрез мягких тканей - линейный. Задача - в кратчайший срок опорожнить большую часть гематомы через фрезевые отверстия, затем после стабилизации витальных функций (обычно через 2-4 ч) продолжить операцию в более благоприятных условиях: выполнить декомпрессивную трепанацию черепа.
Немедленная операция чаще всего показана больным с эпидуральными или обширными субдуральными гематомами, нередко сочетанными с очагами размозжения мозга.
Тактика удаления компримирующего субстрата (чаще это субдуральная гематома) у больных в критическом состоянии осуществляется в два этапа и носит название «Damage control» - контроль повреждений. Часть ранее считавшихся безнадежными больных удается спасти.
Экстренная операция . Подавляющее число больных с острыми и подострыми травматическими внутричерепными гематомами оперируются в экстренном порядке. В этом случае есть небольшой резерв времени (1-2 ч) для уточнения диагноза с помощью инструментальных методов диагностики и подготовки к операции.
Ошибочно использовать все методы дополнительной диагностики - это требует много времени и не несет необходимой для вмешательства информации. После неврологического осмотра делается рентгенография черепа и КТ, а особо тяжелым больным - только КТ.
Показания к экстренной операции:
- общее тяжелое состояние больного;
- нарушение сознания - от глубокого оглушения до комы различной степени тяжести (12-4 балла по шкале ком Глазго - ШКГ);
- повторяющиеся эпилептические припадки;
- гематомы, локализующиеся в задней черепной ямке;
- явные признаки дислокации и ущемления ствола (брадикардия, анизокория, ипсилатерапьные гемипарезы);
- вдавленные переломы свода черепа, сопутствующие внутричерепным гематомам;
- смещение М-эха более 5 мм;
- данные компьютерной томографии (гематомы, влекущие за собой выраженный полушарный и перифокальный отеки мозга со смещением желудочков;
- деформация или полное сдавление желудочка на стороне компрессии;
- деформация базальных цистерн или отсутствие их визуализации).
При этом виде операции выполняют разрез мягких тканей - линейный или подковообразный. Выпиливается костный лоскут размером 6×7; 10×12 см, затем он обычно удаляется и консервируется, твердая мозговая оболочка вскрывается полуовальным разрезом, не ушивается, производится ее пластика аллотрансплантатом с подшиванием в виде фартука или репереном.
Отсроченная операция . Показания к операции ставятся после попытки консервативного лечения, чаще - у больных с внутримозговыми и субдуральными гематомами. Объем гематом- обычно 40-70 см3 на фоне ушиба мозга средней степени тяжести.
Критерии отказа от экстренной операции:
- сознание- ясное или оглушение различной степени тяжести (15-12 баллов по ШКГ);
- отсутствие выраженных дислокационных симптомов (анизокории, пареза взора вверх, ипсилатерапьного пареза конечностей, патологических стопных знаков);
- пульс не реже 60 в минуту, отсутствие грубых нарушений дыхания и кровообращения, обусловленных дислокацией и ущемлением ствола;
- пирамидные симптомы, не достигающие степени грубого пареза или паралича конечностей;
- отсутствие грубых афатических расстройств, повторяющихся эпилептических припадков;
- отсутствие вдавленных переломов свода черепа на краниограммах;
- отсутствие смещения М-эха или его наличие не более 5 мм;
- на КТ внутримозговые гематомы, локализующиеся в передних отделах лобных долей, оболочечные, особенно субдуральные, не влекущие за собой выраженного перифокального отека мозга и смещения срединных структур;
- боковые желудочки и базальные цистерны могут быть поджаты с одной стороны, но прослеживаются.
Дальнейшая тактика определяется стойким или усиливающимся цефалгическим синдромом, углублением нарушений сознания:
- усугубляются или появляются вновь очаговые симптомы (афазия, парезы конечностей, эпиприпадки);
- улавливаются или нарастают признаки дислокации ствола мозга и внутричерепной гипертензии;
- появляются полнокровие вен или застой на глазном дне;
- не уменьшается или увеличивается смещение М-эха;
- отмечается отрицательная динамика по данным КТ (нарастают отек мозга и смещение желудочков, их сдавление и деформация, не визуализируются базальные цистерны, иногда увеличивается первоначальный объем гематомы).
В этих случаях прерывается консервативное лечение и ставятся показания к операции. Как правило, попытка консервативного лечения ограничивается сроком 1-7 сут.
Отсроченное вмешательство должно производиться своевременно. При первых признаках ухудшения состояния больного выполняется костно-пластическая трепанация, реже - декомпрессивная.
Плановая операция производится при хронических супратенториальных гематомах. Понятие «плановая операция» - весьма относительное. Хотя больные - клинически компенсированные, это нередко не соответствует данным инструментальных методов обследования: на КТ/МРТ обнаруживается смещение желудочковой системы, иногда достигающее 15 мм, желудочки поджаты, на глазном дне могут обнаруживаться застойные явления.
Состояние больного позволяет произвести детальное обследование и подготовку к вмешательству, которое осуществляется после подтверждения диагноза. Костнопластическая или декомпрессивная трепанации выполняются в исключительных случаях: при многокамерных гематомах или при необходимости наружной декомпрессии. В подавляющем большинстве гематомы опорожняются через дренаж из 1-2 фрезевых отверстий в течение 3 сут под контролем КТ.
Консервативное лечение возможно главным образом при внутримозговых гематомах, локализующихся в пределах полушарий, и при оболочечных гематомах, объем которых не превышает 40-50 см3.
Состояние больных - изначально компенсированное, сознание - ясное или умеренное оглушение (13-15 баллов по ШКГ). Нет признаков дислокации и ущемления ствола. По данным КТ, смещение срединных структур либо отсутствует, либо не превышает 3-4 мм, визуализируются базальные цистерны.
Оперативное вмешательство при любой клинической форме ТСГМ решает следующие задачи:
- удаление субстрата компрессии;
- достижение надежного гемостаза;
- создание оптимальных условий для последующего восстановления мозговых функций.
Эффективность решения этих задач обеспечивается:
- во-первых, проведением оперативного вмешательства по устранению сдавления мозга до развития дислокационного синдрома или при его начальных стадиях;
- во-вторых, выбором оптимального доступа к субстрату компрессии, использованием операционной оптики и микроинструментов; увеличением операционного поля на 3,2-8,0 ед. в зависимости от этапа вмешательства;
- в-третьих, минимальной травматизацией тканей, особенно мозга, инструментами и шпателями; применением по показаниям малоинвазивных методик.
К малоинвазивным методикам относятся: опорожнение хронических субдуральных гематом через 1-2 фрезевых отверстия; удаление гематом с помощью эндоскопической техники, когда под контролем зрения измельчаются и убираются сгустки крови, достигается гемостаз; лечение оболочечных и внутримозговых гематом методом их тромболизиса.
Через фрезевое отверстие аспирируется жидкая часть гематомы, затем в ее полость через катетер дробно вводится стрептокиназа, при обязательном КТ-контроле. Этот метод особенно показан пожилым и ослабленным больным. Малоинвазивные вмешательства, безусловно, имеют некоторые преимущества перед традиционной трепанацией черепа, однако следует подчеркнуть, что для каждого из них существуют строгие показания и ряд ограничений, когда они не могут быть применены.
- в-четвертых, очень важно адекватное окончание операции. Оптимальным является ушивание или пластика твердой мозговой оболочки, сохранение костного лоскута. Если для пластики твердой мозговой оболочки практически нет противопоказаний, то сохранить костный лоскут после вмешательства, т.е. выполнить костно-пластическую трепанацию, удается не всегда. Декомпрессивная трепанация показана при выраженном отеке и пролабировании мозга, изначально тяжелым декомпенсированным больным, при отсутствии уверенности в надежности гемостаза;
- в-пятых, хирургическое удаление компримирующего мозг субстрата - это, безусловно, важный, но всего лишь этап в лечении больного. Не меньшее значение имеет ведение пострадавшего в послеоперационном периоде, адекватное назначение интенсивной медикаментозной терапии. От того, насколько удастся справиться с отеком мозга, нарушением церебральной гемодинамики, предупредить вторичную травму мозга, воспалительные осложнения, зависят судьба больного и качество его жизни.
Интенсивная терапия тяжелой ЧМТ
Многочисленные рекомендации по интенсивной терапии тяжелой ЧМТ, основанные главным образом на личном опыте авторов, фрагментарных, не всегда корректных исследованиях эффективности того или иного препарата, вносят путаницу и дезориентируют практического врача. Поэтому во всем мире, а в последние годы и в нашей стране интенсивная терапия, в частности при тяжелой ЧМТ, после устранения сдавления головного мозга строится на принципах доказательной медицины.
Они включают определенный алгоритм действий, соблюдение стандартов диагностики и лечения. К сожалению, в настоящее время имеются значительные трудности повсеместного внедрения этих стандартов в практику.
Это обусловлено тем, что они предусматривают необходимость не только клинического динамического наблюдения, но и мониторинга кровообращения, дыхания, оксигенации, внутричерепного давления, газов в артериальной и венозной крови и т.д., возможность многократного КТ-исследования в круглосуточном режиме, что доступно примерно в 15-20% лечебных учреждений, куда госпитализируются больные с ЧМТ.
Основные направления интенсивной терапии: коррекция нарушений внешнего дыхания и гемодинамики, лечение внутричерепной гипертензии, нормализация микроциркуляции и метаболизма мозга, купирование судорожного синдрома, профилактика и лечение внутри- и внецеребральных осложнений, неврологического дефицита.
Борьба с нарушениями внешнего дыхания начинается с обеспечения проходимости воздухоносных путей, вплоть до трахеостомии. Показаниями к искусственной вентиляции легких служат:
- кома (по ШКГ - 8 баллов и менее);
- апноэ или неэффективное дыхание (частота дыхания реже 12 или свыше 35 в минуту);
- патологические типы дыхания;
- ЧМТ, сочетанная с травмой лицевого скелета и/или грудной клетки;
- прогрессирующее ухудшение неврологического статуса;
- серийные эпиприпадки;
- гипоксия и/или гиперкапния (рО2<75 мм рт. ст., рСО2>45 мм рт. ст.).
Наряду с обеспечением адекватного газообмена не менее важными являются контроль и поддержание на необходимом уровне системной гемодинамики .
Во избежание снижения перфузии мозга систолическое артериальное давление должно быть в пределах 100-140 мм рт. ст. Особо нежелательна длительная артериальная гипотензия. Назначается инфузионная терапия (Волювен 6%, Хаес-Стерил 10%, а также Полиглюкин, Макродекс, Желатиноль, Плазма). Если она малоэффективна, проводится инотропная поддержка (допамин - 3 — 8 мкг/кг в минуту).
Причинами внутричерепной гипертензии являются внутричерепные кровоизлияния, отек и набухание головного мозга, нарушения ликвороциркуляции, а также гипоксия и артериальная гипотензия. Мониторинг внутричерепного давления позволяет контролировать и своевременно корригировать интенсивную терапию внутричерепной гипертензии.
Препаратом выбора для ее лечения является 20% раствор маннитола- 0,5 г/кг массы тела; назначают по 4 инфузии через 20 мин + перорально 20 мг фуросемида + 200 мл коллоидов. Обязательными условиями являются нормоволемия и осмолярность не более 32 мосмоль/л.
Ошибочно в острейшем периоде при нарушениях витальных функций, выраженной внутричерепной гипертензии назначать общеизвестные препараты: Церебролизин, Актовегин, Глиатилин, Кортексин, ноотропы идр., которые в этих условиях в лучшем случае бесполезны, а то и вредны. Их применяют обычно спустя 5-10 сут после устранения сдавления мозга.
Проблема травматического сдавления головного мозга далека от окончательного решения, многие ее практически важные аспекты по-прежнему дискутабельны и требуют дальнейшего изучения.
Например, какова должна быть тактика при множественных субстратах компрессии? Какие из них следует удалять и в каких случаях можно оставить внутричерепные гематомы и очаги размозжения и пытаться лечить их консервативно (комбинированное лечение)? Как часто и когда приходится идти на отсроченную операцию в связи с «агрессией» оставленного субстрата?
Необходимо уточнить показания к тому или иному виду оперативного вмешательства при ТСГМ: костно-пластическая или декомпрессивная трепанация, эндоскопия, фибринолиз гематом, а также показания к поэтапному удалению субстратов компрессии, изучить возможности совершенствования интенсивной медикаментозной терапии.
Решение этих вопросов - один из резервов улучшения результатов лечения травматического сдавления головного мозга.
Остеохондроз — основная нозологическая форма дегенеративных заболеваний суставов, межпозвонковых дисков (м/п) и связочного аппарата позвоночника, характеризующаяся хроническим прогрессирующим течением. В основе заболевания лежит нарушение равновесия между анаболическими и катаболическими процессами в гиалиновом хряще межпозвонкового диска, приводящее к нарушению функционирования позвоночного сегмента в целом.
Исходя из морфологии и анатомической структуры м/п диска (до 90% воды в пульпозном ядре и наличия протеогликанов и коллагена в соотношении как 65% к 20% и содержания в фиброзном кольце коллагена до 90%), основными механизмами развития дегенеративных изменений являются:
- недостаточный синтез протеингликанов
- усиление катаболических процессов
- активация коллагеназы, фосфолипазы и цитокинов
- гиперпродукция простагландинов Е2 и т.д.
Данные причины в сочетании с постоянной микротравматизацией позвонкового сегмента от чрезмерных или недозированных нагрузок в повседневной жизни, нарушением правил питания у жителей мегаполисов, постоянными стрессовыми ситуациями на работе и в быту приводят к неизбежному изнашиванию и " уплощению " м/ п диска и развитию такого осложнения как протрузия или грыжа.
Наиболее тяжелыми осложнениями при травматических повреждениях позвоночника является межпозвонковая грыжа.
Клинические проявления заболевания: внезапное появление интенсивных болей в позвоночнике, значительное ограничение подвижности в сегментах позвоночника, иррадиация по типу "ломоты", "жжения, "прохождения электрического тока" и др. по различным поверхностям руки или ноги. Часто первичные боли в позвоночнике могут и не появляться в связи с защитным напряжением мышц спины и блоком поврежденного сегмента. В данных ситуациях происходит постепенное нарастание слабости и мышечных атрофий, приводящих к инвалидизации.
Основными методами лечения межпозвонковых грыж являются оперативное и консервативное лечение.
Тактика лечения
В настоящее время при межпозвонковых грыжах назначается либо оперативное вмешательство или консервативная терапия.
По итогам многолетних наблюдений и результатам оперативного и консервативного методов лечения нами отмечено, что показаниями к операции являются:
- размер грыжевого выпячивания свыше 7 мм с угрозой секвестрации;
- парезы и параличи сфинктеров прямой кишки и мочевого пузыря;
- параличи конечностей и сегментов;
- признаки атрофии мышц на фоне отсутствия функциональной активности корешка;
- неэффективность консервативного лечения в течении 3-х месяцев и более (индивидуальный подход).
И в случаях оперативного лечения и при консервативном лечении наиболее эффективными и доступными медикаментозными средствами являются:
Анальгезирующая терапия:
Раствор анальгина 50%-1,0 - Анальгин 50%-2,0
B12-1000 мкг - Но-шпа -2г
Но-шпа-2г - Лазикс-40мг
Реопирин-5,0 в/м - Новокаин 0,25%-100,0 в/в кап
Противовоспалительная терапия
Вольтарен 50мг 3р в сутки (суппозитории - 2 раза в сутки) Мовалис 1т 2р в день
Найз 0,1 2р в день
Местные аппликации
Димексид 50% рр+новокаин 0,5% -10,0 +гидрокортизон 75мг
Препараты, снимающие мышечный спазм:
Сирдалуд 2мг - 3р в день Миоластан 100мг - 3р в день Ботокс 25-75ЕД в/м
Баклофен 10мг - 3р вдень
Мидокалм
Стимуляция микроциркулляции
Трентал 0,4 - 3р в день Теоникол 0,3г - 3р в день Никотиновая кислота 1.0-6.0 в/м
Актовегин 2,0 - в/м
Антиоксидантная терапия
Токоферол (вит Е)- 0,3г в день Витамин С 0,5г в день
Тиоктовая кислота (Тиоктацид, Эспалипон, Берлитион) 0,6г в день - 3-4 месяца
Мексидол 0,125г - 3р вдень - 1 месяц и более
Коррекция психосоматических расстройств
Одним из главных аспектов комплексной терапии является вторичная (в ранних случаях диагностики - первичная) профилактика прогрессирующих процессов дегенерации хрящевой ткани при помощи хондропротективной терапии (хондропротекторы), вызывающей:
- стимуляцию синтеза протеогликанов и коллагеновых волокон хондроцитами
- снижение активности лизосомальных ферментов
- увеличение резистентности хондроцитов к воздействию цитокинов
- активацию анаболических процессов
Основные группы препаратов:
- Гликозамин сульфат (ДОНА, Виатрил, Артрил, Остемин) - восполняют дефицит глюкозаминов в организме, стимулируют синтез хондроитинсерной кислоты (1,5г в день в течении 6 недель, в последующем - перерыв на два месяца (с последующим повтором) Может вызывать инсулинрезинстентность
- Хондроитин - сульфат (Структум) - 1,5 г в день в течении 4-8 недель
- Препараты гиалуроновой кислоты (Гиалуронан, Синвикс, Остенил,терафлекс,артра)
- Алфлутоп - содержит мукополисахариды, пептиды, аминокислоты, К, Ca) - тормозит активность гиалуронидазы (в/м 1,0 - 20 дней)
- Диацерин
- Эстрогены
- Неомыляющие соединения авокадо и сои (Пиаскледин 300) - стиулирует синтез протеингликанов, коллагеновых волокон, угнетает продукцию плазминогена,
- чрезкожное введение противовоспалительных препаратов: ПАНТОГЕМАТОГЕН и КАРИПАЗИМ.