- Влияние на основные функции организма: активация энзимов, синтез белков, здоровье сердечных артерий, нервная функция.
- Минимальная суточная потребность (RDA) и лучшие пищевые источники данного минерала: 150 мг - зерновые каши, специальные рыбные блюда, листья зеленых растений.
- Синергизм с пищевыми добавками и другими витаминами и минералами (улучшение и потенциирование воздействия на организм): В 6 , С, кальций, фосфор.
- Симптомы дефицита: недостаточный рост, судороги ног, нервозность.
- Факторы, снижающие уровень данного минерала в организме: избыток железа.
- Химические характеристики:
- порядковый N - 12
- атомный вес - 24,32
При нагревании легко сгорает, превращаясь в окись - MgO - жженую магнезию. При этом происходит магниевая вспышка. Легко соединяется с галлоидами, а при нагревании - с серой и азотом.
Окись магния представляет собой белый порошок, легко растворимый в кислотах; с водой окись магния образует гидрат - Mg(OH) 2 , являющийся основанием средней силы.
Большинство солей магния хорошо растворимы в воде.
Присутствие ионов магния сообщает жидкости горький вкус.NB! Ближайшим соседом магния в группе является кальций, с которым магний вступает в обменные реакции. Эти два элемента легко вытесняют друг друга из соединений.
- Общие сведения:
Магний один из самых распространенных элементов в природе. Особенно много хлористого магния в морской воде. Питьевая вода также содержит ионы магния.
В растительном мире магний играет важную роль, входя в состав хлорофилла. Без магния не может быть ни зеленых растений, ни питающихся ими животных. - Физиология:
Магний поступает в организм с пищей, водой и солью. Особенно богата магнием растительная пища. Часть ионизированного магния отщепляется от магнезиальных солей пищи еще в желудке и всасывается в кровь. Основная часть труднорастворимых солей магния переходит в кишечник и только после соединения их с жирными и щелочными кислотами всасывается в кровь. Эти комплексные соединения магния поступают в печень. Пути их дальнейшего распространения по органам пока не изучены.
Главное "депо" магния находится в костях и мышцах. В костях фосфорно-кислого магния содержится 1,5%, в эмали зубов - 0,75% (в кариозных зубах - 0,83-1,88%).Концентрация магния в крови человека составляет 2,3-4,0 мг%.
Ежедневная потребность в магнии - 0,6 мг.
Нормально магний выделяется почками в виде фосфатов, но главным образом кишечником в количестве 0,2-0,3 мг/ сутки. - Значение:
Магний является необходимой составной частью всех клеток и тканей, участвуя в месте с ионами других элементов в сохранении ионного равновесия жидких сред организма.
Магний входит в состав ферментов, связанных с обменом фосфора и углеводов. Магний активирует фосфатазу плазмы и костей и участвует в процессе нервно-мышечной возбудимости. - Избыток магния и его проявления:
Большие дозы магнезиальных солей оказывают в основном слабительных эффект (особенно сульфат магния).
При парентеральном введении сульфата магния наблюдаются симптомы: общее угнетение, вялость, сонливость, наркоз наступает при концентрации магния до 15-18 мг% (вместо нормы - 4 мг%).
Способность магнезиальных солей вызывать наркоз была впервые обнаружена Мельцером и Ауэром в 1905 году.
При более детальном изучении этого явления было установлено, что 25% раствор MgSO 4 , вводимый в интрадуральное пространство действует подобно кокаину, вызывая полную анестезию. - Недостаток магния и его проявления:
При снижении концентрации магния в крови, ниже границы нормы (2,3-4,0 мг), наблюдаются симптомы возбуждения нервной системы вплоть до судорог.
Уменьшение магния в крови у грудных детей (особенно при искусственном вскармливании) может привести к тетании. Это объясняется тем, что хотя содержание магния в коровьем молоке в 4 раза больше, чем в женском, усваивется магний из коровьего молока намного труднее.
У детей обеднение крови магнием отмечается и при рахите и в этом случае введение магния рахитичным детям способствует улучшению соотношения в организме Са:Р.
Выключение магния из диеты, богатой кальцием обуславливает задержку кальция во всех тканях, в особенности - сердечной мышце и почках, что приводит к их обызвествлению.
Наука, которая изучает эти элементы, — химия. Таблица Менделеева, опираясь на которую можно изучать данную науку, показывает нам, что протонов и нейтронов, содержащихся в атоме магния, по двенадцать. Это можно определить по порядковому номеру (он равен количеству протонов, а электронов будет столько же, если это нейтральный атом, а не ион).
Химические особенности магния также изучает химия. Таблица Менделеева также необходима для их рассмотрения, так как она показывает нам валентность элемента (в данном случае она равняется двум). Она зависит от группы, к которой относится атом. Кроме того, с ее помощью можно узнать, что молярная масса магния равняется двадцати четырем. То есть один моль данного металла весит двадцать четыре грамма. Формула магния очень проста — он состоит не из молекул, а из атомов, объединенных кристаллической решеткой.
Характеристика магния с точки зрения физики
Как и все металлы, кроме ртути, данное соединение имеет твердое агрегатное состояние в нормальных условиях. Оно обладает светло-серой окраской со своеобразным блеском. Данный металл имеет довольно высокую прочность. На этом физическая характеристика магния не заканчивается.
Рассмотрим температуру плавления и кипения. Первая равняется шестисот пятидесяти градусам по шкале Цельсия, вторая составляет тысяча девяносто градусов Цельсия. Можно сделать вывод, что это достаточно легкоплавкий металл. Кроме того, он очень легкий: его плотность — 1,7 г/см3.
Магний. Химия
Зная физические особенности данного вещества, можно перейти ко второй части его характеристики. Данный металл обладает средним уровнем активности. Это можно увидеть из электрохимического ряда металлов — чем пассивнее он, тем правее находится. Магний является одним из первых слева. Рассмотрим по порядку, с какими веществами он реагирует и как это происходит.
С простыми
К таковым относятся те, молекулы которых состоят только из одного химического элемента. Это и кислород, и фисфор, и сера, и многие другие. Сначала рассмотрим взаимодействие с оксигеном. Оно называется горением. При этом образуется оксид данного металла. Если сжечь два моля магния, потратив при этом один моль кислорода, получим два моля оксида. Уравнение данной реакции записывается следующим образом: 2Mg + О 2 = 2MgO. Кроме того, при горении магния на открытом воздухе образуется также его нитрид, так как данный металл параллельно реагирует с азотом, содержащимся в атмосфере.
При сжигании трех молей магния тратится один моль нитрогена, и в результате получаем один моль нитрида рассматриваемого металла. Уравнение такого рода химического взаимодействия можно записать таким образом: 3Mg + N 2 = Mg 3 N 2 .

Кроме того, магний способен реагировать и с другими простыми веществами, такими как галогены. Взаимодействие с ними происходит только при условии нагревания компонентов до очень высоких температур. В таком случае происходит реакция присоединения. К галогенам относятся такие простые вещества: хлор, йод, бром, фтор. И реакции называются соответствующе: хлорирование, йодирование, бромирование, фторирование. Как уже можно было догадаться, в результате таких взаимодействий можно получить хлорид, йодид, бромид, фторид магния. К примеру, если взять один моль магния и столько же йода, получим один моль йодида данного металла. Выразить эту химическую реакцию можно с помощью следующего уравнения: Mg + І 2 = MgI 2 . По такому же принципу проводится и хлорирование. Вот уравнение реакции: Mg + Cl 2 = MgCl 2 .
Кроме этого, металлы, в том числе и магний, реагируют с фосфором и серой. В первом случае можно получить фосфид, во втором — сульфид (не путать с фосфатами и сульфатами!). Если взять три моля магния, добавить к нему два моля фосфора и разогреть до нужной температуры, образуется один моль фосфида рассматриваемого металла. Уравнение данной химической реакции выглядит следующим образом: 3Mg + 2Р = Mg 3 P 2 . Точно так же, если смешать магний и серу в одинаковых молярных пропорциях и создать необходимые условия в виде высокой температуры, получим сульфид данного металла. Уравнение подобного химического взаимодействия можно записать так: Mg + S = MgS. Вот мы и рассмотрели реакции этого металла с другими простыми веществами. Но химическая характеристика магния на этом не заканчивается.
Реакции со сложными соединениями
К таким веществам относятся вода, соли, кислоты. С разными группами металлы реагируют по-разному. Рассмотрим все по порядку.
Магний и вода
При взаимодействии данного металла с самым распространенным химическим соединением на Земле образуется оксид и водород в виде газа с резким неприятным запахом. Для проведения такого рода реакции компоненты также нужно нагреть. Если смешать по одному молю магния и воды, получим по столько же оксида и водорода. Уравнение реакции записывается следующим образом: Mg + Н 2 О = MgO + Н 2 .
Взаимодействие с кислотами
Как и другие химически активные металлы, магний способен вытеснять атомы гидрогена из их соединений. Такого рода процессы называются В таких случаях происходит замена атомами металлов атомов гидрогена и формирование соли, состоящей из магния (или другого элемента) и кислотного осадка. Например, если взять один моль магния и добавить его к в количестве два моля, образуется один моль хлорида рассматриваемого металла и столько же водорода. Уравнение реакции будет выглядеть так: Mg + 2HCl = MgCl 2 + Н 2 .
Взаимодействие с солями
Как из кислот образуются соли, мы уже рассказали, но характеристика магния с точки зрения химии подразумевает и рассмотрение его реакций с солями. В данном случае взаимодействие может произойти, только если металл, входящий в состав соли, менее активен, чем магний. К примеру, если взять по одному молю магния и сульфата меди, получим сульфат рассматриваемого металла и чистую медь в равном молярном соотношении. Уравнение такого рода реакции можно записать в следующем виде: Mg + CuSO 4 = MgSO 4 + Cu. Здесь проявляются восстановительные свойства магния.

Применение данного металла
Благодаря тому что он по многим параметрам превосходит алюминий — легче его приблизительно в три раза, но при этом в два раза прочнее, он получил широкое распространение в различных отраслях промышленности. В первую очередь это авиастроение. Здесь сплавы на основе магния занимают первое место по популярности среди всех используемых материалов. Кроме того, он используется в химической промышленности в качестве восстановителя для добывания некоторых металлов из их соединений. Благодаря тому что при горении магний образует очень мощную вспышку, его используют в военной промышленности для изготовления сигнальных ракет, светошумовых боеприпасов и др.
Получение магния
В основном сырьем для этого служит хлорид рассматриваемого металла. Делается это путем электролиза.
Качественная реакция на катионы данного металла
Это специальная процедура, предназначенная для того, чтобы определить присутствие ионов какого-либо вещества. Чтобы протестировать раствор на наличие соединений магния, можно добавить к нему карбонат калия или натрия. В результате образуется белый осадок, который легко растворяется в кислотах.
Где этот металл можно найти в природе?
Данный химический элемент является довольно распространенным в природе. Земная кора почти на два процента состоит из этого металла. Он встречается в составе многих минералов, таких как карналлит, магнезит, доломит, тальк, асбест. Формула первого минерала выглядит так: KCl.MgCl 2 .6Н 2 О. Он выглядит как кристаллы голубоватого, бледно-розового, блекло-красного, светло-желтого либо прозрачного цвета.

Магнезит — это его химическая формула — MgCO 3 . Он имеет белую окраску, но в зависимости от примесей, может иметь серый, бурый или желтый оттенок. Доломит имеет следующую химическую формулу: MgCO 3 .СаСО 3 . Это желтовато-серый либо минерал, обладающий стеклянным блеском.
Тальк и асбест имеют более сложные формулы: 3MgO.4SiO 2 .Н 2 О и 3MgO.2SiO 2 .2Н 2 О соответственно. Благодаря своей высокой жароустойчивости они широко используются в промышленности. Кроме того, магний входит в химический состав клетки и структуру многих органических веществ. Это мы рассмотрим подробнее.
Роль магния для организма
Данный химический элемент важен как для растительных, так и для животных существ. Магний для организма растений просто жизненно необходим. Так же, как железо является основой гемоглобина, нужного для жизни животных, так магний представляет собой главный компонент хлорофилла, без которого не может существовать растение. Данный пигмент участвует в процессе фотосинтеза, при котором в листьях синтезируются из неорганических соединений питательные вещества.

Магний для организма животных также очень нужен. Массовая доля данного микроэлемента в клетке — 0,02-0,03%. Несмотря на то что его так мало, он выполняет очень важные функции. Благодаря ему поддерживается структура таких органоидов, как митохондрии, отвечающие за клеточное дыхание и синтез энергии, а также рибосомы, в которых образуются белки, необходимые для жизнедеятельности. Кроме того, он входит в химический состав многих ферментов, которые нужны для внутриклеточного обмена веществ и синтеза ДНК.
Для организма в целом магний необходим, чтобы принимать участие в обмене глюкозы, жиров и некоторых аминокислот. Также с помощью данного микроэлемента может передаваться нервный сигнал. Кроме всего вышеперечисленного, достаточное содержание магния в организме снижает риск сердечных приступов, инфарктов и инсультов.
Симптомы повышенного и пониженного содержания в организме человека
Недостаток магния в организме проявляется такими основными признаками, как повышенное артериальное давление, усталость и низкая работоспособность, раздражительность и плохой сон, ухудшение памяти, частое головокружение. Также может наблюдаться тошнота, судороги, дрожь в пальцах, спутанность сознания — это признаки очень пониженного уровня поступления с едой данного микроэлемента.

Недостаток магния в организме приводит к частым респираторным заболеваниям, нарушениям в работе сердечно-сосудистой системы, а также диабету второго типа. Далее рассмотрим содержание магния в продуктах. Чтобы избежать его недостатка, нужно знать, какая еда богата данным химическим элементом. Нужно учитывать еще и то, что многие из этих симптомов могут проявляться и при обратном случае - избытке магния в организме, а также при недостатке таких микроэлементов, как калий и натрий. Поэтому важно внимательно пересмотреть свой рацион и разобраться в сути проблемы, лучше всего это сделать с помощью специалиста-диетолога.
Как было упомянуто выше, данный элемент является основной составляющей хлорофилла. Поэтому можно догадаться, что большое его количество содержится в зелени: это сельдерей, укроп, петрушка, цветная и белокочанная капуста, листья салата и т. д. Также это многие крупы, в особенности гречка и пшено, а еще овсянка и ячневая. Кроме того, данным микроэлементом богаты орехи: это и кешью, и грецкий орех, и арахис, и фундук, и миндаль. Также большое количество рассматриваемого металла содержится в бобовых, таких как фасоль и горох.

Немало его содержится и в составе водорослей, к примеру в морской капусте. Если употребление данных продуктов происходит в нормальном количестве, то ваш организм не будет испытывать недостатка в рассмотренном в этой статье металле. Если же у вас нет возможности регулярно кушать еду, перечисленную выше, то лучше всего приобрести пищевые добавки, в состав которых входит этот микроэлемент. Однако перед этим нужно обязательно проконсультироваться с врачом.
Вывод
Магний - один из самых важных металлов в мире. Он нашел широкое применение в многочисленных отраслях промышленности - от химической до авиационной и военной. Более того, он очень важен с биологической точки зрения. Без него невозможно существование ни растительных, ни животных организмов. Благодаря данному химическому элементу, осуществляется процесс, дающий жизнь всей планете, - фотосинтез.
Это природный транквилизатор и антистрессовый минерал!
Магний - один из самых распространенных элементов в природе, является неотъемлемым компонентом костей и зубной эмали у человека и животных, а у растений входит в состав хлорофилла. Ионы магния содержатся в питьевой воде, а в морской воде много хлористого магния.
В организме содержится 20-30 г магния. Примерно 1% магния находится в жидкостях организма, а остальные 99% в костной (около 40%) и в мягких тканях (около 59%).
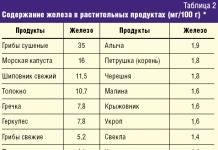
Продукты богатые магнием
Указано ориентировочное наличие в 100 г продукта
Суточная потребность в магнии 400-500 мг.
Потребность магния возрастает при:
- стрессе;
- содержании в рационе большого количества белка;
- быстром формировании новых тканей - у детей, бодибилдеров;
- беременности и кормлении грудью;
- приеме мочегонных средств.
Усваиваемость
Магний всасывается в основном в двенадцатиперстной кишке и немного в толстой кишке. Но хорошо всасываются только органические соединения магния, например, органические соединения магния в составе комплексов с аминокислотами, органическими кислотами (лактат магния, цитрат магния) и пр. Неорганические соли (сульфат магния) всасываются очень плохо.
Избыточное поступление в организм кальция (Ca), фосфора (P), натрия (Na), жиров ухудшает усвоение магния. Пищевые волокна связывают магний, а избыточное количество алкоголя, кофеина и калия (K) увеличивают потери магния с мочой.
Полезные свойства магния и его влияние на организм
Магний играет значительную роль в организме - он необходим для нормального функционирования около 300 ферментов. Вместе с кальцием (Ca) и фосфором (P) магний участвует в формировании здоровых костей.
Магний необходим для обмена глюкозы, аминокислот, жиров, транспорта питательных веществ, требуется для выработки энергии. Магний участвует в процессе синтеза белков, передаче генетической информации, нервных сигналов. Необходим для поддержания сердечно-сосудистой системы в здоровом состоянии. Адекватный уровень магния уменьшает вероятность сердечных приступов.
Магний нормализует деятельность мышц, снижает содержание холестерина, способствует очищению организма от некоторых видов токсических веществ.
Магний вместе с Витамином B6 (Пиридоксин) предупреждает образование камней в почках. Если не хватает только магния, почечные камни чаще всего бывают фосфатными (соединения кальция с фосфором), а если не хватает только Витамина B6 - появляются оксалатные камни (соединения кальция (Ca) с щавелевой кислотой).
Он известен как антистрессовое вещество - дополнительное количество магния способствует повышению устойчивости к стрессу. Соли магния угнетают рост злокачественных образований.
Также магний помогает в борьбе с переутомлением - рекомендуется употреблять добавки, содержащие магний, при хронических переутомлениях.
Взаимодействие с другими эссенциальными элементами
Магний совместно с натрием (Na) и фосфором (P) участвует в мышечной и нервной деятельности организма. Витамин D регулирует обмен магния, тем самым способствует повышению эффективности его действия. Витамин E , витамин B6 и калий (K) также улучшают обмен магния. При нехватке магния калий (K) не удерживается внутри клеток.
В организме человека кальций и магний должны находиться в определенном соотношении друг с другом. Считается, что это соотношение должно быть не больше чем 1:0,6. Так, при дефиците магния, кальций будет теряться с мочой, а избыток кальция, в свою очередь, вызывает дефицит магния.
Нехватка и переизбыток магния
Признаки нехватки магния
- бессонница, утренняя усталость (даже после долгого сна);
- раздражительность, повышенная чувствительность к шуму, недовольство;
- головокружение, потеря равновесия;
- появление мерцающих точек перед глазами;
- изменения в кровяном давлении, нарушение сердцебиения;
- мышечные спазмы, судороги, подергивания;
- спазматические боли в желудке, сопровождающиесяпоносом;
- выпадение волос, ломкость ногтей;
- частые головные боли.
Признаки избытка магния
- сонливость, нарушение координации, речи;
- заторможенность;
- замедление пульса;
- тошнота, рвота, понос;
- сухость слизистых оболочек (особенно полости рта).
К повышенному содержанию магния в крови (гипермагниемия) приводит избыточный прием препаратов магния, без компенсации добавками кальция (Ca).
Факторы, влияющие на содержание магния в продуктах
Современные методы обработки пищевых продуктов снижают содержание магния. Даже из богатых магнием продуктов он теряется, если продукты вымачивать в воде, но не использовать в пищу отвары и настои.
Минеральные элементы.doc
Минеральные вещества1. Роль минеральных элементов в организме человека 1
2. Макроэлементы, их характеристика
3. Микроэлементы, их характеристика
4. Влияние технологической обработки
На минеральный состав пищевых продуктов
5. Методы определения минеральных веществ
1. Роль минеральных элементов в организме человека
Многие элементы в виде минеральных солей, ионов, комплексных соединений и органических веществ входят в состав живой материи и являются незаменимыми нутриентами, которые должны ежедневно потребляться с пищей. Содержание минеральных веществ в основных продуктах питания приведено в табл. 5.1.
Как определить недостаток магния в организме?
Первым признаком существенных металлов является обратная картина симптомов и восстановление оптимального роста крупного рогатого скота. Со временем биохимические исследования привели к выделению ферментов, которые требовали функционирования ионов металлов, и вскоре после того, как эти специфические ферменты могли быть связаны с симптомами дефицита.
Изменения со стороны пищеварительной системы
Взаимодействия ионов металлов рассматривались как вредные, а также ценные для системы. Например, раннее исследование показало, что медь усиливает действие железа для облегчения анемии у лабораторных крыс, кормивших диету на основе молока; это наблюдение повторялось у цыплят и свиней и вскоре привлекло внимание клиницистов, которые приняли аналогичный биметаллический протокол для лечения анемичных людей. Наряду с появлением полуочищенных диет в то же время наука о питании была поставлена на порог важных открытий о роли основных минеральных элементов.
В соответствии с рекомендацией диетологической комиссии Национальной академии США ежедневное поступление химических элементов с пищей должно находиться на определенном уровне (табл. 5.2). Столько же химических элементов должно ежесуточно выводиться из организма, поскольку их содержание в нем находится в относительном постоянстве.
Минеральные кофакторы содержат большую группу неорганических веществ с большинством ионов металлов. Область ионов металлов включает макрометаллы, ионы следовых металлов и металлоиды. При поиске причины их необходимости мы должны понимать, что ионы металлов подходят для выполнения опасных химических реакций на ферментативных поверхностях, реакций, которые могли бы повредить более чувствительные органические боковые цепи аминокислот в ферменте. Например, окислительно-восстановительные металлы, такие как железо, марганец и медь, могут принимать электроны в своей структуре, временно удерживая их, а затем доносить их до кислорода, образуя воду как способ безопасного удаления электрона.
Роль минеральных веществ в организме человека чрезвычайно разнообразна, несмотря на то, что они не являются обязательным компонентом питания. Минеральные вещества содержатся в протоплазме и биологических жидкостях, играют основную роль в обеспечении постоянства осмотического давления, что является необходимым условием для нормальной жизнедеятельности клеток и тканей. Они входят в состав сложных органических соединений (например, гемоглобина, гормонов, ферментов), являются пластическим материалом для построения костной и зубной ткани. В виде ионов минеральные вещества участвуют в передаче нервных импульсов, обеспечивают свертывание крови и другие физиологические процессы организма.
В сущности, следует учитывать, что металлический кофактор расширяет репертуар доступных каталитических функций и выполняется ферментами. Ферменты, которые зависят от ионов металлов как кофакторов, делятся на 2 категории: ферменты, активированные металлами и металлоферментами. Как следует из названия, активированные металлом ферменты подстрекаются к более высокой каталитической активности за счет присутствия моно или двухвалентного иона металла на внешней стороне белка. Металл может активировать субстрат, непосредственно связать фермент или прийти в равновесие с ферментом, используя его ионный заряд, чтобы получить более благоприятную связь с субстратом или лучшей каталитической средой.
В зависимости от количества минеральных веществ в организме человека и пищевых продуктах их подразделяют на макро - и микроэлементы. Так, если массовая доля элемента в организме превышает 10 -2 %, то его следует считать макроэлементом. Доля микроэлементов в организме составляет 10 -3 -10 -5 %. Если содержание элемента ниже 10 -5 %, его считают ультрамикроэлементом. К макроэлементам относят калий, натрий, кальций, магний, фосфор, хлор и серу. Они содержатся в количествах, измеряемых сотнями и десятками миллиграммов на 100 г тканей или пищевого продукта. Микроэлементы входят в состав тканей организма в концентрациях, выражаемых десятыми, сотыми и тысячными долями миллиграмма и являются необходимыми для его нормальной жизнедеятельности. Микроэлементы условно делят на две группы: абсолютно или жизненно необходимые (кобальт, железо, медь, цинк, марганец, иод, бром, фтор) и так называемые вероятно необходимые (алюминий, стронций, молибден, селен, никель, ванадий и некоторые другие). Микроэлементы называют жизненно необходимыми, если при их отсутствии или недостатке нарушается нормальная жизнедеятельность организма.
Распределение микроэлементов в организме зависит от их химических свойств и очень разнообразно. Железо, например, является составной частью гемоглобина, миоглобина и других дыхательных пигментов, то есть веществ, участвующих в поглощении и транспорте кислорода во все ткани организма; атомы меди входят в активный центр ряда ферментов и т.д.
Следовательно, активированные металлом ферменты требуют, чтобы металл присутствовал в избытке, возможно, в 2-10 раз превышающем концентрацию фермента. Поскольку металл не может связываться более постоянным образом, активированные металлом ферменты обычно теряют активность во время очистки.
Металлоферменты, напротив, имеют металлический кофактор, плотно связанный с определенной областью на поверхности белка. За некоторыми исключениями, следовые металлы входят в картину как кофакторы для металлоферментов. Сильный союз делает невозможным потеря металлического иона путем диализа или потери слабыми диссоциативными агентами. Металлоферменты, однако, могут потерять свой металлический кофактор и стать неактивными при обработке металлическими хелаторами, которые имеют более сильную аффинность связывания, чем фермент, и преодолевают ферментный белок ионом металла.
Действие микроэлементов может быть и опосредованным - через влияние на интенсивность или характер обмена веществ. Так, некоторые микроэлементы (например, марганец, цинк, иод) влияют на рост, и их недостаточное поступление в организм с пищей тормозит нормальное физическое развитие ребенка. Другие микроэлементы (например, молибден, медь, марганец) принимают участие в репродуктивной функции, и их недостаток в организме отрицательно влияет на эту сторону жизнедеятельности человека.
В качестве протезных групп металлы в металлоферментах имеют стехиометрическое соотношение, представленное полным интегратором. Металлоферменты редко готовятся для повышения активности путем добавления их конъюгированного иона металла к ферменту. Пространственная геометрия также вызывает беспокойство: металлы в первой серии переходных процессов должны придерживаться строгих геометрических конфигураций вокруг участка связывания металла.
За исключением тех, которые имеют цинк, ферменты с металлами из первой серии переходных процессов имеют тенденцию быть очень яркими; например, красный цвет гемоглобина или синий цвет церулоплазмина, связанный с медью. Большинство ферментов с железом соединяют железо либо в виде гема, либо в виде специального расположения железа с серными группами, известными как центры железа-серы. Железо в геме показывает сильное сходство с ионами магния в хлорофилле. Хеме, которая в основном представляет собой порфириновую кольцевую систему с железом, расположенным в центре, является наиболее распространенной формой железа в биологических белках.
К наиболее дефицитным минеральным веществам в питании современного человека относятся кальций и железо, к избыточным - натрий и фосфор.
Недостаток или избыток в питании каких-либо минеральных веществ вызывает нарушение обмена белков, жиров, углеводов, витаминов, что приводит к развитию ряда заболеваний. Ниже приведены характерные (типичные) симптомы при дефиците различных химических элементов в организме человека: Наиболее распространенным следствием несоответствия в рационе количества кальция и фосфора является кариес зубов, разрежение костной ткани. При недостатке фтора в питьевой воде разрушается зубная эмаль, дефицит йода в пище и воде приводит к заболеваниям щитовидной железы. Таким образом, минеральные вещества очень важны для устранения и профилактики ряда заболеваний.
Наиболее распространенные соединения
В качестве компонента центров железа-серы железо входит в несколько групповых схем с остатками цистеина в ферментах, которые обеспечивают более прямой контакт с белком. Железо в этих центрах связывается с субстратами, а также переносит электроны и участвует в реакциях, которые включают дегидратацию и перегруппировку. Ферменты с центрами железа-серы включают ксантиноксидазу, сукцинатдегидрогеназу, аконитазу и азотную кислоту.
Эта компоновка позволяет ферменту удалить атом водорода из очень стабильной связи С-Н. Неметалл может заменить железо в этих комплексах. Ферменты с группой гема обычно красновато-коричневого цвета. Цвет мотивировал первоначальный интерес к этим белкам и был мотивирующим фактором для обозначения гем белков в митохондриях как «цитохромы».


Перечислим причины нарушения обмена минеральных веществ, которые могут иметь место даже при их достаточном количестве в пище:
А) несбалансированное питание (недостаточное или избыточное количество белков, жиров, углеводов, витаминов и др.);
Хотя только несколько растворимых ферментов имеют железо в качестве кофактора, железо особенно заметно в мембрано-связанных белках, которые содержат пути переноса электронов. Редокс-свойство железа играет большую часть своей химии как кофактора. Железо почти всегда связано с переносом электронов и часто жертвует электроны молекуле кислорода.
Как каталаза, так и пероксидаза, два фермента гема, используют железо для взаимодействия с опасными окислителями. Оба фермента расположены в цитозоле и в пероксисомах, где происходят вредные реакции окисления в ходе нормальных метаболических событий. Возможно, наиболее знакомым железосодержащим ферментом является цитохромовая с-оксидаза, концевой акцептор электронов в транспортной цепи митохондриального электрона и фермент, способный делить молекулу кислорода на образование воды.
Б) применение методов кулинарной обработки пищевых продуктов, обуславливающих потери минеральных веществ, например, при размораживании (в горячей воде) мяса, рыбы, или при удалении отваров овощей и фруктов, куда переходят растворимые соли;
В) отсутствие своевременной коррекции состава рационов при изменении потребности организма в минеральных веществах, связанной с физиологическими причинами. Так, например, у людей, работающих в условиях повышенной температуры внешней среды, увеличивается потребность в калии, натрии, хлоре и других минеральных веществах в связи стем, что большая их часть выводится из организма с потом;
Роль магния в организме человека
Цинк, пожалуй, является самым распространенным и универсальным из всех металлических кофакторов. Более 300 ферментов имеют цинк-кофактор. Приблизительно 3% генома у млекопитающих кодирует белки пальцев цинка. В качестве кофактора цинк может выполнять как структурные, так и каталитические функции. Эти примеры иллюстрируют, почему цинк является важным компаньоном для ферментов и белков.
Цинк считается мягким металлом, потому что он ведет себя как двухвалентный катион без особых геометрических предпочтений. Возможно, эта мягкость позволяет цинку адаптироваться ко многим различным ферментативным средам. По этой причине цинковые комплексы не имеют цвета, а сам цинк ведет себя в основном как катион. Другим примером является использование цинка для поляризации сложного эфира или амидной связи, тем самым способствуя нуклеофильной атаке воды на соединение, как в реакциях, катализируемых карбоксипептидазой и аминопептидазой.
Г) нарушение процесса всасывания минеральных веществ в желудочно-кишечном тракте или повышение потерь жидкости (например, кровопотери).
^
2. Макроэлементы, их характеристика
Кальций.
Это основной структурный компонент костей и зубов; входит в состав ядер клеток, клеточных и тканевых жидкостей, необходим для свертывания крови. Кальций образует соединения с белками, фосфолипидами, органическими кислотами; участвует в регуляции проницаемости клеточных мембран, в процессах передачи нервных импульсов, в молекулярном механизме мышечных сокращений, контролирует активность ряда ферментов. Таким образом, кальций
выполняет не только пластические функции, но и влияет на многие биохимические и физиологические процессы в организме.
Медь, как и железо, представляет собой окислительно-восстановительный металл. Ферменты с медью, хотя и не столь многочисленны, как ферменты с цинком, выполняют важные биологические функции, главным образом в цитозоле. Наиболее сложные ферменты включают мультикорекс-оксидазы, которые могут иметь всего 4 или целых 8 атомов меди на фермент. Медь в этих ферментах существует в трех различных химических средах, известных как медные участки типа 1, типы 2 и тип. Сайт медного типа 1 дает синий цвет церулоплазминам и другим синим белкам с медью.
Места связывания меди в многоокиси оксидазе образуют триаду, состоящую из меди меди 2 и 3 типа 3, расположенных в равнобедренном треугольнике. Кислород связывается с этими двумя медиками типа 3 в основании треугольника. Из-за своей склонности принимать электроны медь является мощным окислителем в биологических системах. Эта реакция связывает метаболизм железа с медью и может объяснить, как отсутствие меди в железе предотвращает перенос железа и вызывает анемию у людей. Редко медь призвана играть только структурную роль, и многие ферменты, которые имеют медь в качестве кофактора, используют металл в активном месте.
Кальций относится к трудноусвояемым элементам. Поступающие в организм человека с пищей соединения кальция практически не растворимы в воде. Щелочная среда тонкого кишечника способствует образованию трудноусвояемых соединений кальция, и лишь воздействие желчных кислот обеспечивает его всасывание.
Ассимиляция кальция тканями зависит не только от содержания его в продуктах, но и от соотношения его с другими компонентами пищи и, в первую очередь, с жирами, магнием, фосфором, белками. При избытке жиров возникает конкуренция за желчные кислоты и значительная часть кальция выводится из организма через толстый кишечник. На всасывание кальция отрицательно сказывается избыток магния; рекомендуемое соотношение этих элементов составляет 1: 0,5. Если количество фосфора превышает уровень кальция в пище более чем в 2 раза, то образуются растворимые соли, которые извлекаются кровью из костной ткани. Кальций поступает в стенки кровеносных сосудов, что обуславливает их ломкость, а также в ткани почек, что может способствовать возникновению почечно-каменной болезни. Для взрослых рекомендовано соотношение кальция и фосфора в пище 1:1,5. Трудность соблюдения такого соотношения обусловлена тем, что большинство широко потребляемых продуктов значительно богаче фосфором, чем кальцием. Отрицательное влияние на усвоение кальция оказывает фитин и щавелевая кислота, содержащиеся в ряде растительных продуктов. Эти соединения образуют с кальцием нерастворимые соли.
Исследования связывают ионы меди с образованием артерий или ангиогенеза. Одно из самых захватывающих открытий, которое еще предстоит полностью понять, заключается в том, что лишение животного меди задерживается или даже ингибирует рост раковых опухолей. С точки зрения питания это может означать, что медь необходима для развития микрососудистой системы.
Знаете ли вы, что
Хотя цинк может быть наиболее распространенным переходным металлом в ферментах, марганец, пожалуй, наименее распространен, отчасти потому, что комплексы марганца с белками, как правило, слабо стабильны и легко диссоциируют. Известные металлоферменты марганца включают пируват-карбоксилазу и марганец-супероксид-дисмутазу в митохондриях и аргиназе в цикле мочевины. Марганец может также функционировать в качестве активирующего металл кофактора для многих ферментов, которые требуют магния.
Суточная потребность в кальции взрослого человека составляет 800 мг, а у детей и подростков - 1000 мг и более.
При недостаточном потреблении кальция или при нарушении всасывания его в организме (при недостатке витамина D) развивается состояние кальциевого дефицита. Наблюдается повышенное выведение его из костей и зубов. У взрослых развивается остеопороз - деминерализация костной ткани, у детей нарушается становление скелета, развивается рахит.
Особенности питания при недостатке магния
Хотя марганец не считается окислительно-восстановительным металлом на основе его реакционной способности, он тем не менее может существовать в 6 состояниях окисления, три из которых не наблюдаются в биологических системах. Кобальт прикрепляется квадратным плоским расположением к кольцу, аналогичному гей, но с очень особыми характеристиками. В отличие от гема, кобальт имеет 2 осевых лиганда, которые свободны от белка, что позволяет белковым группам получить доступ к центральному металлу над и под плоскостью.
Лучшими источниками кальция являются молоко и молочные продукты, различные сыры и творог (100-1000 мг/100 г продукта), зеленый лук, петрушка, фасоль. Значительно меньше кальция содержится в яйцах, мясе, рыбе, овощах, фруктах, ягодах (20-40 мг/100 г продукта).
Магний. Этот элемент необходим для активности ряда ключевых ферментов, обеспечивающих метаболизм организма. Магний участвует в поддержании нормальной функции нервной системы и мышцы сердца; оказывает сосудорасширяющее действие; стимулирует желчеотделение; повышает двигательную активность кишечника, что способствует выведению шлаков из организма (в том числе холестерина).
Чем опасен для беременных дефицит магния?
В одном октаэдрическом комплексе одно аксиальное положение обычно занято одним бензимидазолом, а другое - метильной группой. Устройство уникально и позволяет кобальту образовывать связи углерод-металл с потенциалом для двух различных реакций. Например, метильную группу можно удалить в виде иона карбония, удерживая оба электрона в кобальте, который затем возвращается к менее стабильному.
В позиционных перестановках кобальт сохраняет только один электрон и образует устойчивый соион 7 с высвобождением свободного радикала. Свободные радикалы очень реакционноспособны и преодолевают энергетические барьеры, которые могут удерживать другие реагенты. Таким образом, химические свойства групп переноса кобальта, таких как ионы карбония, или высокореактивные углерод-центрированные радикалы. Оба продукта возможны и объясняют необходимость кобальта в качестве кофактора для реакции, протекающей через механизм свободных радикалов.
Усвоению магния мешают наличие фитина и избыток жиров и кальция в пище. Ежедневная потребность в магнии точно не определена; считают, однако, что доза 200-300 мг/сут предотвращает проявление недостаточности (предполагается, что всасывается около 30% магния).
При недостатке магния нарушается усвоение пищи, задерживается рост, в стенках сосудов откладывается кальций, развивается ряд других патологических явлений. У человека недостаток ионов магния, обусловленный характером питания, крайне маловероятен. Однако большие потери этого элемента могут происходить при диарее; последствия их сказываются, если в организм вводятся жидкости, не содержащие магний. Когда концентрация магния в сыворотке снижается примерно до 0,1 ммоль/л, может возникать синдром, напоминающий белую горячку: у человека наступает полукоматозное состояние, наблюдается мышечная дрожь, спазмы мышц в области запястья и стопы, повышение нервно-мышечной возбудимости в ответ на звуковые, механические и зрительные раздражители. Введение магния вызывает быстрое улучшение состояния.
Магнием богаты в основном растительные продукты. Большое количество его содержат пшеничные отруби, различные крупы (40 - 200 мг/100 г продукта), бобовые, урюк, курага, чернослив. Мало магния в молочных продуктах, мясе, рыбе, макаронных изделиях, большинстве овощей и фруктов (20 - 40 мг/100 г).
Калий . Около 90% калия находится внутри клеток. Он вместе с другими солями обеспечивает осмотическое давление; участвует в передаче нервных импульсов; регуляции водно-солевого обмена; способствует выведению воды, а, следовательно, и шлаков из организма; поддерживает кислотно-щелочное равновесие внутренней среды организма; участвует в регуляции деятельности сердца и других органов; необходим для функционирования ряда ферментов.
Калий хорошо всасывается из кишечника, а его избыток быстро удаляется из организма с мочой. Суточная потребность в калии взрослого человека составляет 2000-4000 мг. Она увеличивается при обильном потоотделении, при употреблении мочегонных средств, заболеваниях сердца и печени. Калий не является дефицитным нутриентом в питании, и при разнообразном питании недостаточность калия не возникает. Дефицит калия в организме появляется при нарушении функции нервно-мышечной и сердечно-сосудистой систем, сонливости, снижении артериального давления, нарушении ритма сердечной деятельности. В таких случаях назначается калиевая диета.
Большая часть калия поступает в организм с растительными продуктами. Богатыми источниками его являются урюк, чернослив, изюм, шпинат, морская капуста, фасоль, горох, картофель, другие овощи и плоды (100 - 600 мг/100 г продукта). Меньше калия содержится в сметане, рисе, хлебе из муки высшего сорта (100 - 200 мг/100 г).
Натрий. Натрий содержится во всех тканях и биологических жидкостях организма. Он участвует в поддержании осмотического давления в тканевых жидкостях и крови; в передаче нервных импульсов; регуляции кислотно-щелочного равновесия, водно-солевого обмена; повышает активность пищеварительных ферментов.
Метаболизм натрия всесторонне изучен благодаря его физиологическим свойствам и важности для организма. Этот нутриент легко всасывается из кишечника. Ионы натрия вызывают набухание коллоидов тканей, что обуславливает задержку воды в организме и противодействует ее выделению. Общее количество натрия во внеклеточной жидкости, таким образом, определяет объем этих жидкостей. Возрастание концентрации натрия в плазме приводит к ощущению жажды. В жарком климате и при тяжелой физической работе происходит существенная потеря натрия с потом и необходимо введение в организм соли для восполнения утраченного количества.
В основном ионы натрия поступают в организм за счет поваренной соли - NaCl. При избыточном потреблении хлористого натрия ухудшается удаление растворимых в воде конечных продуктов обмена веществ через почки, кожу и другие выделительные органы. Задержка воды в организме осложняет деятельность сердечно-сосудистой системы, способствует повышению кровяного давления . Поэтому потребление соли при соответствующих заболеваниях в пищевом рационе ограничивают. Вместе с тем при работе в горячих цехах или жарком климате увеличивают количество натрия (в виде поваренной соли), вводимого извне, чтобы компенсировать его потерю с потом и уменьшить потоотделение, отягощающее функцию сердца.
Натрий естественно присутствует во всех пищевых продуктах. Способ получения пищевых продуктов в значительной мере определяет конечное содержание в нем натрия. Например, замороженный зеленый горошек содержит гораздо больше натрия, чем свежий. Свежие овощи и фрукты содержат его от менее чем 10 мг/кг до 1 г/кг, в отличие от круп и сыра, которые могут содержать натрий в количестве 10 - 20 г/кг.
Оценка среднесуточного поступления натрия с пищей затруднена, поскольку его концентрация в пище широко варьируется и, кроме того, люди привыкли подсаливать пищу. Взрослый человек ежедневно потребляет до 15 г поваренной соли и столько же выделяет ее из организма. Это количество значительно превышает физиологически необходимое и определяется, прежде всего, вкусовыми качествами хлористого натрия, привычкой к соленой пище. Содержание поваренной соли в пище человека можно без ущерба для здоровья снизить до 5 г в сутки. На выделение хлористого натрия из организма, а, следовательно, и на потребность в нем, влияет количество солей калия, получаемое организмом. Растительная пища, особенно картофель, богата калием и усиливает выделение с мочой хлористого натрия, а, следовательно, и повышает потребность в нем.
Фосфор. Фосфор входит в состав всех тканей организма, особенно мышц и мозга. Этот элемент принимает участие во всех процессах жизнедеятельности организма: синтезе и расщеплении веществ в клетках; регуляции обмена веществ; входит в состав нуклеиновых кислот и ряда ферментов; необходим для образования АТФ.
В тканях организма и пищевых продуктах фосфор содержится в виде фосфорной кислоты и ее органических соединений (фосфатов). Основная его масса находится в костной ткани в виде фосфорнокислого кальция, остальной фосфор входит в состав мягких тканей и жидкостей. В мышцах происходит наиболее интенсивный обмен соединений фосфора. Фосфорная кислота участвует в построении молекул многих ферментов, нуклеиновых кислот и т. д.
При длительном дефиците фосфора в питании организм использует собственный фосфор из костной ткани. Это приводит к деминерализации костей и нарушению их структуры - разрежению. При обеднении организма фосфором снижается умственная и физическая работоспособность, отмечается потеря аппетита, апатия.
Суточная потребность в фосфоре для взрослых составляет 1200 мг. Она возрастает при больших физических или умственных нагрузках, при некоторых заболеваниях.
Большое количество фосфора содержится в продуктах животного происхождения, особенно в печени, икре, а также в зерновых и бобовых. Его содержание в этих продуктах составляет от 100 до 500 мг в 100 г продукта. Богатым источником фосфора являются крупы (овсяная, перловая), в них содержится 300-350 мг фосфора/100 г. Однако из растительных продуктов соединения фосфора усваиваются хуже, чем при потреблении пищи животного происхождения.
Сера. Значение этого элемента в питании определяется, в первую очередь, тем, что он входит в состав белков в виде серосодержащих аминокислот (метионина и цистина), а также является составной частью некоторых гормонов и витаминов.
Как компонент серосодержащих аминокислот сера участвует в процессах белкового обмена, причем потребность в ней резко возрастает в период беременности и роста организма, сопровождающихся активным включением белков в образующиеся ткани, а также при воспалительных процессах. Серосодержащие аминокислоты, особенно в сочетании с витаминами С и Е, оказывают выраженное антиоксидантное действие. Наряду с цинком и кремнием сера определяет функциональное состояние волос и кожи.
Хлор. Этот элемент участвует в образовании желудочного сока, формировании плазмы, активирует ряд ферментов. Этот нутриент легко всасывается из кишечника в кровь. Интересна способность хлора отлагаться в коже, задерживаться в организме при избыточном поступлении, выделяться с потом в значительных количествах. Выделение хлора из организма происходит главным образом с мочой (90%) и потом.
Нарушения в обмене хлора ведут к развитию отеков, недостаточной секреции желудочного сока и др. Резкое уменьшение содержания хлора в организме может привести к тяжелому состоянию, вплоть до смертельного исхода. Повышение его концентрации в крови наступает при обезвоживании организма, а также при нарушении выделительной функции почек.
Суточная потребность в хлоре составляет примерно 5000 мг. Хлор поступает в организм человека в основном в виде хлористого натрия при добавлении его в пищу.
^
3. Микроэлементы, их характеристика
Железо.
Этот элемент необходим для биосинтеза соединений, обеспечивающих дыхание, кроветворение; он участвует в иммунобиологических и окислительно-восстановительных реакциях; входит в состав цитоплазмы, клеточных ядер и ряда ферментов.
Ассимиляции железа препятствует щавелевая кислота и фитин. Для усвоения этого нутриента необходим витамин В 12 . Усвоению железа способствует также аскорбиновая кислота, поскольку железо всасывается в виде двухвалентного иона.
^ Недостаток железа в организме может привести к развитию анемии, нарушаются газообмен, клеточное дыхание, то есть фундаментальные процессы обеспечивающие жизнь. Развитию железодефицитных состояний способствуют: недостаточное поступление в организм железа в усвояемой форме, понижение секреторной активности желудка, дефицит витаминов (особенно В 12 , фолиевой и аскорбиновой кислот) и ряд заболеваний, вызывающих кровопотери.
Потребность взрослого человека в железе (14 мг/сут) с избытком удовлетворяется обычным рационом. Однако при использовании в пище хлеба из муки тонкого помола, содержащего мало железа, у городских жителей весьма часто наблюдается дефицит железа. При этом следует учесть, что зерновые продукты, богатые фосфатами и фитином, образуют с железом труднорастворимые соединения и снижают его ассимиляцию организмом.
Железо - широко распространенный элемент. Он содержится в субпродуктах, мясе, яйцах, фасоли, овощах, ягодах. Однако в легкоусвояемой форме железо содержится только в мясных продуктах, печени (до 2000 мг/100 г продукта), яичном желтке.
Медь . Медь является необходимым элементом в метаболизме человека, играя роль в образовании эритроцитов, высвобождении тканевого железа и развитии скелета, центральной нервной системы и соединительной ткани.
Поскольку медь широко распространена в пищевых продуктах, маловероятно, чтобы у людей, за исключением, возможно, грудных детей, получающих исключительно молочный рацион, когда-либо развилась форма недостаточности питания, связанная с медью.
Потребление избыточно больших доз меди человеком ведет к раздражению и разъеданию слизистых, распространенному поражению капил ляров, поражению печени и почек, раздражению центральной нервной системы. Суточная потребность в этом элементе составляет около 2 мг. Источниками меди являются такие пищевые продукты, как печень, яичный желток, зеленые овощи.
Йод. Иод является необходимым элементом, участвующим в образовании гормона тироксина. При недостаточности иода развивается зобная болезнь - заболевание щитовидной железы.
Потребность в йоде колеблется в пределах 100-150 мкг в день. Содержание йода в пищевых продуктах обычно невелико (4-15 мкг%). Наиболее богаты йодом продукты моря. Так, в морской рыбе его содержится около 50 мкг/100 г, в печени трески до 800, в морской капусте в зависимости от вида и сроков сбора - от 50 мкг до 70 000 мкг/100 г продукта. Но надо учесть, что при длительном хранении и тепловой обработке пищи значительная часть йода (от 20 до 60%) теряется.
Содержание йода в наземных растительных и животных продуктах сильно зависит от его количества в почве. В районах, где йода в почве мало, содержание его в пищевых продуктах может быть в 10 - 100 раз меньше среднего. Поэтому в этих районах для предупреждения зобной болезни добавляют в поваренную соль небольшое количество иодата калия (25 мг на 1 кг соли). Срок хранения такой йодированной соли - не более 6 месяцев, так как при хранении соли йод постепенно улетучивается.
Фтор. При недостатке этого элемента развивается кариес зубов (разрушение зубной эмали). Избыток фтора также оказывает негативное влияние на организм, поскольку соли фтора, накапливаясь в костях, вызывают изменение цвета и формы зубов, остеохондроз, а вслед за этим огрубление суставов и их неподвижность, костные наросты. Разница между полезной и вредной дозами фтора так мала, что многие исследователи выступают против фторирования воды.
Фтор, потребляемый с водой, почти полностью всасывается, содержащийся в пище фтор всасывается в меньшей степени. Поглощенный фтор равномерно распределяется по всему организму. Он удерживается, главным образом, в скелете, и небольшое его количество отлагается в зубной ткани. В высоких дозах фтор может вызывать нарушение углеводного, липидного, белкового обмена, а также метаболизма витаминов, ферментов и минеральных солей.
В различных странах были проведены оценки суточного поступления фтора с пищей; для взрослых эта величина варьируется от 0,2 до 3,1 мг, для детей возрастной группы от 1 до 3 лет поступление фтора было оценено на уровне 0,5 мг/сут.
Практически все пищевые продукты содержат хотя бы микроколичества этого элемента. Все виды растительности содержат некоторое количество фтора, которое они получают из почвы и воды. В отдельных продуктах, в частности, в рыбе, некоторых овощах и чае обнаруживаются высокие уровни содержания фтора. Применение фторированной воды на предприятиях пищевой промышленности может нередко удваивать уровень содержания фтора в готовых продуктах.
Для профилактики и лечения кариеса зубов используют различные зубные пасты, порошки, эликсиры, жевательные резинки и т.п., которые содержат добавляемый к ним фтор, главным образом в неорганической форме. Эти соединения обычно вносятся в средства для чистки зубов, как правило, в концентрациях около 1 г/кг.
Хром . Этот элемент, по-видимому, необходим для глюкозного и липидного обмена и для утилизации аминокислот некоторыми системами. Он также имеет важное значение для профилактики легких форм диабета и атеросклероза у человека.
Хром всасывается как из желудочно-кишечного тракта, так и из дыхательных путей. Поглощаемое количество его неодинаково для каждой из этих систем и зависит от формы хрома. Трехвалентный хром является эссенциальной формой элемента для человека, шестивалентный хром - токсичен. Хром распределяется по тканям человеческого организма в неодинаковых, но обычно низких концентрациях. Уровни содержания хрома во всех тканях, помимо легких, снижаются с возрастом. Наибольшие количества хрома у человека накапливаются в коже, мышцах и жировой ткани. Гомеостатические механизмы, включая механизмы транспорта в печени и кишечнике, препятствуют избыточному накоплению трехвалентного хрома. Хром медленно выводится из организма, главным образом с мочой.
Сегодня принято считать нормой потребления около 150 мг хрома в сутки. Особенно он полезен пожилым людям, организм которых плохо усваивает углеводы, а хром усиливает процессы обмена именно этих соединений. Неорганический хром усваивается плохо, гораздо легче - в органических соединениях, т. е. в той форме, в которой он находится в живых организмах.
Продукты питания значительно варьируются по уровням содержания хрома, которые лежат в диапазоне от 20 до 550 мкг/кг. Богатыми источниками хрома являются пивные дрожжи, печень (10-80 мкг/100 г). В меньших количествах этот элемент содержится в картофеле с кожурой, говядине, свежих овощах, хлебе из муки грубого помола, сыре.
Марганец. Марганец необходим как кофактор в ряде ферментных систем; он играет роль в правильном функционировании флавопротеинов, в синтезе сульфированных мукополисахаридов, холестерина, гемоглобина и во многих других процессах метаболизма . Из поступившего внутрь марганца всасывается лишь около 3%.
Всасывание марганца тесно связано с усвоением железа. Потребность в марганце составляет 0,2 -0,3 мг на 1 кг веса человека в день. Больше всего марганца содержится в клюкве и чае, немного меньше в каштанах, какао, овощах, фруктах (100-200 мкг/100 г).
^ Никель. Никель признан незаменимым микроэлементом относительно недавно. В настоящее время установлена его роль в качестве кофермента в процессах метаболизма железа. При этом увеличение поступления в организм железа сопровождается увеличением потребности в пищевом никеле. Кроме того, никель способствует усвоению меди - еще одного незаменимого для кроветворения элемента. Важность пищевого или выделенного из натуральных продуктов никеля подчеркивается тем, что синтетические соединения данного элемента относятся к канцерогенным веществам.
Никель присутствует в большинстве пищевых продуктов, однако в концентрациях ниже (и часто намного ниже) 1 мг/кг. Поступление никеля с пищей, по имеющимся данным, варьируется от менее чем 200 до 900 мкг/сут. С обычной диетой поступает около 400 мкг/сут. Было показано, что в винах и в пиве содержание никеля равно, соответственно, 100 и 50 мкг/л.
Цинк. Данный микроэлемент в качестве кофермента участвует в широком спектре реакций биосинтеза белка (более 70) и метаболизма нуклеиновых кислот (включая процессы репликации ДНК и транскрипции), обеспечивающих, в первую очередь, рост и половое созревание организма. При этом цинк, наряду с марганцем, является специфическим микроэлементом, влияющим на состояние половой функции, а именно на активность некоторых половых гормонов, сперматогенез, развитие мужских половых желез и вторичных половых признаков. Кроме того, в последнее время рассматривается роль цинка в предотвращении гипертрофических процессов в предстательной железе.
Цинк вместе с серой участвует в процессах роста и обновления кожи и волос. Наряду с марганцем и медью цинк в значительной степени обеспечивает восприятие вкусовых и обонятельных ощущений. Цинк в качестве незаменимого компонента входит в состав молекулы инсулина, причем уровень его оказывается сниженным у больных сахарным диабетом. Очень важно, что данный микроэлемент является коферментом алкоголь-дегидрогеназы, обеспечивающей метаболизм этилового спирта. При этом уровень всасываемости цинка при хроническом алкоголизме резко снижен. Так называемая «куриная слепота» (т. е. нарушение ночного видения) может развиваться не только в отсутствии витамина А, но и цинка. Цинк вместе с витамином В 6 обеспечивает метаболизм ненасыщенных жирных кислот и синтез простагландинов.
Цинк очень важен для процессов пищеварения и усвоения питательных веществ. Так, цинк обеспечивает синтез важнейших пищеварительных ферментов в поджелудочной железе, а также участвует в образовании хиломикронов - транспортных частиц, в составе которых пищевые жиры могут всасываться в кровь. Цинк наряду с витаминами группы В является важным регулятором функций нервной системы. В условиях дефицита цинка могут возникать эмоциональные расстройства, эмоциональная неустойчивость, раздражительность, а в очень тяжелых случаях - нарушения функций мозжечка. Наконец, все больше данных накапливается в пользу участия цинка в процессах созревания лимфоцитов и реакциях клеточного иммунитета.
Суточная потребность в цинке 8000-22000 мкг%. Она вполне удовлетворяется обычным рационом. Среднесуточное поступление цинка только с питьевой водой составляет порядка 400 мкг. Содержание цинка в пищевых продуктах обычно колеблется в пределах 150-25000 мкг%. Однако в печени, мясе и бобовых оно достигает 3000 - 5000 мкг%. Иногда, дефицит цинка может испытывать организм детей и подростков, которые недостаточно употребляют животные продукты.
^ Селен. Еще в середине XX в. селен не только не рассматривался наукой о питании, но даже считался очень токсичным элементом с канцерогенными свойствами. Однако уже в 60-х гг. было установлено, что при недостатке селена страдает сердечно-сосудистая система, что проявляется прогрессирующим атеросклерозом и слабостью сердечной мышцы, а в условиях хронического дефицита селена может развиваться практически неизлечимая кардиомиопатия. В последнее время на уровне современных исследований находит подтверждение одно из важных наблюдений древнекитайской медицины, указывающее на то, что адекватное обеспечение организма селеном способствует замедлению процесса старения и ведет к долголетию. Интересно заметить, что знаменитые лечебные сорта зеленого чая, поставлявшиеся с целью достижения здоровья и долголетия в императорские дворцы в Древнем Китае, выращивались в тех горных провинциях, в почвах которых уже в настоящее время с помощью современных аналитических методов определяется высокое содержание селена.
После открытия селена было установлено, что витамин Е и селен действуют на разные звенья одного процесса и являются строго взаимодополняющими друг друга, то есть их антиокислительная активность при совместном применении резко возрастает. Синергизм обоих антиоксидантов особенно интересен в контексте противораковой активности. Так, было показано, что назначение препаратов селена одновременно с витамином Е значительно усиливало антиканцерогенный эффект в отношении экспериментальных опухолей.
Поступление селена с пищей зависит от условий и характера потребления пищи и уровня содержания селена в пищевых продуктах. Овощи и фрукты являются, в основном, бедным источником поступления селена в отличие от зерна, зерновых продуктов, мяса (особенно субпродуктов), продуктов моря, которые содержат существенные количества селена, обычно намного превышающие 0,2 мг/кг в пересчете на сырую массу . Химический состав почвы и содержание в ней селена существенно влияют на количество селена в зерне, варьирующее в пределах от 0,04 мг/кг до 21 мг/кг.
Молибден. Общее количество молибдена в организме взрослого человека составляет порядка 7 мг. Содержание молибдена в крови составляет около 0,5 мкг на 100 мл. Более высокие концентрации этого элемента были обнаружены у людей, проживающих в регионах, где почва наиболее богата соединениями этого металла. Так, в некоторых районах Армении отмечены частые случаи заболевания подагрой у жителей, которые питаются в основном местными продуктами, в которых были обнаружены чрезвычайно высокие уровни молибдена. Содержание его в рационе питания жителей этого района составляло 10 -15 мг. В других районах, где случаи подагры встречались реже, люди с пищей получали всего 1-2 мг молибдена в день.
Молибден является составной частью ряда ферментов, таких как ксантиноксидоза, альдегидоксидаза, сульфатоксидаза. Известно, что молибден тормозит развитие кариеса.
Предполагаемая дневная потребность в молибдене составляет 2 мкг на 1 кг массы тела. В России суточное потребление молибдена составляет 0,27 мг.
Наиболее богаты молибденом различные виды овощей (например бобовые) и внутренние органы животных.
Кобальт. Биологическое действие кобальта известно с 1948 г., когда учеными Рикесом и Смитом было установлено, что атом кобальта является центральным в молекуле витамина В 12. Максимальная концентрация кобальта в тканях равна около 100 мкг/кг. Общее содержание кобальта в организме взрослого человека составляет 5 мг. Человек с пищей ежедневно получает 5,63 -7,94 мкг кобальта, из которых 73 - 97% усваивается.
Средняя суточная потребность в кобальте составляет 60 мкг на 1 кг массы тела. Считают, что человек нуждается в кобальте только в виде цианокобаламина (витамин В 12). В некоторых странах соединения кобальта применяли в качестве пищевой добавки к пиву для стабилизации пены. Однако выяснилось, что такая добавка явилась причиной сердечных заболеваний у потребителей пива. Поэтому в настоящее время от использования соединений кобальта в виде пищевой добавки отказались.
^
4 Влияние технологической обработки на минеральный состав пищевых продуктов
При переработке пищевого сырья, как правило, происходит снижение содержания минеральных веществ (кроме Na, добавляемого в виде пищевой соли). В растительных продуктах они теряются с отходами. Так, содержание ряда макро- и особенно микроэлементов при получении крупы и муки после обработки зерна снижается, так как в удаляемых оболочках и зародышах этих компонентов находится больше, чем в целом зерне. Сравнительный анализ минерального состава в пшеничной муке высшего сорта и муки из цельносмолотого зерна приведен ниже (содержание элементов указано в мг/100 г продукта):

Например, в среднем, в зерне пшеницы и ржи зольных элементов содержится около 1,7%, в муке же в зависимости от сорта от 0,5 (в высшем сорте) до 1,5% (в обойной). При очистке овощей и картофеля теряется от 10 до 30% минеральных веществ. Если их подвергают тепловой кулинарной обработке, то в зависимости от технологии (варки, обжаривании, тушении) теряется еще от 5 до 30%.
Мясные, рыбные продукты и птица в основном теряют такие макроэлементы, как кальций и фосфор, при отделении мякоти от костей.
При тепловой кулинарной обработке (варке, жарении, тушении) мясо теряет от 5 до 50% минеральных веществ. Однако если обработку вести в присутствии костей, содержащих много кальция, то возможно увеличение содержания кальция в кулинарно обработанных мясных продуктах на 20%.
В технологическом процессе за счет недостаточно качественного оборудования может переходить в конечный продукт некоторое количество микроэлементов. Так, при изготовлении хлеба при тестоприготовлении в результате контакта теста с оборудованием содержание железа может увеличиваться на 30%. Этот процесс нежелательный, поскольку вместе с железом в продукт могут переходить и токсичные элементы, содержащиеся в виде примесей в металле. При хранении консервов в жестяных сборных (то есть спаянных) банках с некачественно выполненным припоем или при нарушении защитного лакового слоя в продукт могут переходить такие высокотоксичные элементы как свинец, кадмий, а также олово.
Следует учесть, что ряд металлов, таких как железо и медь, даже в небольших концентрациях могут вызвать нежелательное окисление продуктов. Их каталитические окислительные способности особенно ярко проявляются в отношении жиров и жировых продуктов. Так, например при концентрации железа выше 1,5 мг/кг и меди 0,4 мг/кг при длительном хранении сливочного масла и маргаринов эти металлы вызывают прогоркание продуктов. При хранении напитков в присутствии железа выше 5 мг/л и меди 1 мг/л при определенных условиях часто может наблюдаться помутнение напитков.
^
5. Методы определения минеральных веществ
Для анализа минеральных веществ в основном используются физико-химические методы - оптические и электрохимические.
Практически все эти методы требуют особой подготовки проб для анализа, которая заключается в предварительной минерализации объекта исследования. Минерализацию можно проводить двумя способами: «сухим» и «мокрым». «Сухая» минерализация предполагает проведение при определенных условиях обугливания, сжигания и прокаливания исследуемого образца. «Мокрая» минерализация предусматривает еще и обработку объекта исследования концентрированными кислотами (чаще всего HNO 3 и H 2 SO 4).
^ Спектральные методы анализа.
Фотоэлектроколориметрия - анализ, основанный на измерении поглощения окрашенными растворами монохроматического излучения видимой области спектра. Измерения проводят с помощью фотоэлектроколориметров, снабженных узкополосыми светофильтрами. Если исследуемое вещество не окрашено, его необходимо перевести в окрашенное соединение, проведя химическую реакцию с определенными реагентами (фотометрическую аналитическую реакцию).
Спектрофотометрия - метод анализа, основанный на измерении поглощения монохроматического излучения в ультрафиолетовой, видимой и инфракрасной областях спектра. Такие измерения проводят с помощью спектрофотометров, где в качестве монохроматизаторов используются диспергирующие призмы и дифракционные решетки.
Количественный анализ исследуемого иона обычно проводят методом градуировочного графика.
Эмиссионный спектральный анализ. Методы эмиссионного спектрального анализа основаны на измерении длины волны, интенсивности и других характеристик света, излучаемого атомами и ионами вещества в газообразном состоянии. Эмиссионный спектральный анализ позволяет определить элементарный состав неорганических и органических веществ.
Интенсивность спектральной линии определяется количеством возбужденных атомов в источнике возбуждения, которое зависит не только от концентрации элемента в пробе, но и от условий возбуждения. При стабильной работе источника возбуждения связь между интенсивностью спектральной линии и концентрацией элемента (если она достаточно мала) имеет линейный характер, т. е. в данном случае количественный анализ можно также проводить методом градуировочного графика.
Наибольшее применение в качестве источника возбуждения получили электрическая дуга, искра, пламя. Температура дуги достигает 5000 - 6000°С. В дуге удается получить спектр почти всех элементов. При искровом разряде развивается температура 7000 - 10000°С и происходит возбуждение всех элементов. Пламя дает достаточно яркий и стабильный спектр испускания. Метод анализа с использованием в качестве источника возбуждения пламени называют пламенно-эмиссионным анализом. Этим методом определяют свыше сорока элементов (щелочные и щелочноземельные, Сu 2 ,Мn 2 и др.).
^ Атомно-абсорбционная спектроскопия . Метод основан на способности свободных атомов элементов в газах пламени поглощать световую энергию при характерных для каждого элемента длинах волн.
В атомно-абсорбционной спектроскопии практически полностью исключена возможность наложения спектральных линий различных элементов, т. к. их число в спектре значительно меньше, чем в эмиссионной спектроскопии.
Уменьшение интенсивности резонансного излучения в условиях атомно-абсорбционной спектроскопии подчиняется экспоненциальному закону убывания интенсивности в зависимости от толщины слоя и концентрации вещества, аналогичному закону Бугера-Ламберта-Бера
Постоянство толщины светопоглощающего слоя (пламени) достигается с помощью горелок специальной конструкции. Методы атомно-абсорбционного спектрального анализа находят широкое применение для анализа практически любого технического или природного объекта, особенно в тех случаях, когда необходимо определить небольшие количества элементов.
Методики атомно-абсорбционного определения разработаны более чем для 70 элементов.
^ 2. Электрохимические методы анализа.
Ионометрия. Метод служит для определения ионов К , Na , Ca 2 , Mn 2 , F - , I - , Сl - и т. д.
Метод основан на использовании ионоселективных электродов, мембрана которых проницаема для определенного типа ионов (отсюда, как правило, высокая селективность метода).
Количественное содержание определяемого иона проводится либо с помощью градуировочного графика, который строится в координатах Е - рС, либо методом добавок. Метод стандартных добавок рекомендуется использовать для определения ионов в сложных системах, содержащих высокие концентрации посторонних веществ.
Полярография. Метод переменно-токовой полярографии используют для определения токсичных элементов (ртуть, кадмий, свинец, медь, железо).
Метод основан на изучении вольтамперных кривых, полученных при электролизе электроокисляющегося или электровосстанавливающегося вещества. В качестве индикаторного электрода в полярографии чаще всего применяют ртутный капельный электрод, иногда твердые микроэлектроды - платиновый, графитовый. В качестве электрода сравнения используют либо ртуть, налитую на дно электролизера, либо насыщенный каломельный полуэлемент.
По мере увеличения напряжения наступает момент, когда все ионы, поступающие к электроду за счет диффузии, немедленно разряжаются и концентрация их в приэлектродном слое становится постоянной и практически равной нулю. Ток, протекающий в это время в цепи, называют предельным диффузионным током.
Количественный полярографический анализ основан на использовании прямой пропорциональной зависимости величины диффузионного тока от концентрации определяемого элемента.
^ МИНЕРАЛЬНЫЕ ЭЛЕМЕНТЫ
Минеральные (зольные) элементы находятся в пищевых продуктах в виде органических и неорганических соединений. Они входят в состав многих органических
веществ различных классов - белков, жиров, гликозидов, ферментов и др. Обычно минеральные элементы определяют в золе после сжигания пищевых продуктов, так как точно определить, в состав каких веществ и в каком количестве входят эти элементы, довольно трудно.
Роль минеральных элементов в жизни человека, животных и растений огромна: все физиологические процессы в живых организмах протекают при участии этих элементов. Так, в организме человека и животных минеральные элементы участвуют в пластических процессах, формировании и построении тканей, в водном обмене, в поддержании осмотического давления крови и других жидкостей организма, в поддержании кислотно-щелочного равновесия в организме, входят в комплекс веществ, составляющих живую протоплазму клеток, в состав некоторых эндокринных желез и т. д.
Минеральный состав организмов с возрастом меняется; при старении наблюдается минерализация организмов. Так, новорожденные дети содержат около 34 г минеральных веществ на 1 кг массы тела, у взрослого человека содержание этих веществ повышается до 43 г и более.
В теле человека и животных обнаружено свыше 70 минеральных элементов. Многие ферментативные процессы, протекающие в различных тканях организма, требуют участия ряда минеральных элементов. Так, для превращения пировиноградной кислоты в уксусную или глюкозы во фруктозу либо фосфо глицерина в глюкозо-6-маннозо-6- и фруктозе-6-фосфат обязательно участие ионов магния. Ионы кальция тормозят развитие указанного процесса.
Минеральные вещества неравномерно распределены в тканях организма человека. В твердых тканях преобладают двухвалентные элементы: кальций (Са) и магний (Mg), а в мягких тканях - одновалентные: калий (К) и натрий (Na). В твердых тканях к тому же накапливается много фосфора (Р), главным образом в виде фосфорнокислых солей. При недостатке в пище минеральных веществ эти соединения выводятся из организма и нарушается нормальный обмен веществ.
Минеральные вещества, растворенные в плазме крови, межклеточной и других жидкостях организма, создают определенное осмотическое давление, которое зависит от молярной концентрации растворенных в жидкости веществ. Соли повышают осмотическое давление в большей
степени, чем неэлектролиты при той же молярной кон-цеятрации, так как соли диссоциируют с образованием ионов. Осмотическое давление зависит от суммарного количества недиссоциированных молекул и ионов. Осмотическое давление крови, лимфы и межклеточной жидкости организма человека и животных зависит главным образом от растворенной в них поваренной соли (NaCl).
Осмотическое давление в жидкостях организмов влияет на распределение в тканях воды и растворенных веществ. У высших животных осмотическое давление постоянно и составляет 7,5 - 9,0 атм. Поддержание постоянного осмотического давления обеспечивается деятельностью выделительных органов, главным образом почек и потовых желез.
Поступление в кровь минеральных солей приводит к поступлению в кровь межклеточной воды, и поэтому концентрация соли в крови снижается. Затем избыток воды и соли удаляется почками. Снижение в тканях воды, рефлекторно действуя на нервные центры, вызывает жажду.
Нормальная жизнедеятельность организма человека может протекать только при определенных свойствах межклеточной и межтканевой жидкостей. В этом постоянстве среды важную роль играет кислотно-щелочное равновесие, при котором реакция крови, лимфы и других жидкостей организма близка к нейтральной. Кислотно-щелочное равновесие поддерживается благодаря сложной системе регуляторов, объединяемых в единое целое центральной нервной системой . Такими регуляторами являются буферные системы крови, обмен кислорода и углекислоты, углекислых и хлористых солей, выделительные функции почек, легких, потовых желез и др.
В процессе сложного превращения в организме человека продуктов, богатых кальцием, магнием, натрием или калием, могут образовываться щелочные соединения. К источникам щелочеобразующих элементов следует отнести плоды, овощи, бобовые культуры, молоко и кисломолочные продукты.
Другие продукты, такие, как мясо, рыба, яйца, сыр, хлеб, крупа, макароны, в процессе превращения в организме человека дают кислые соединения.
Характер питания может оказывать влияние на сдвиги кислотно-щелочного равновесия в тканях организма человека. Кислотно-щелочное равновесие чаще сдвигается > сторону кислотности. В результате резкого сдвига
допускаемые максимальные нормы содержания золы, и при оценке таких продуктов в них определяют ее количество.
Обычно различают два понятия - «общая (сырая) зола» и «чистая зола». Под понятием «общая зола» подразумевают сумму минеральных элементов или их окислов, входящих в химическую структуру пищевых продуктов, а также внесенных в продукт при его производстве или "попавших случайно в качестве примесей. «Чистая зола» означает сумму минеральных элементов или их окислов без примесей.
Зольность продукта определяют сжиганием. Для этого навеску сначала осторожно сжигают, а затем прокаливают до постоянной массы. Повышенное против нормы количество золы указывает на загрязнение продукта песком, металлическими частицами, землей.
Для определения «чистой золы» полученную золу обрабатывают 10 % -ной соляной кислотой. При этом «чистая зола» растворяется в соляной кислоте, а остаток будет свидетельствовать о наличии в продукте посторонних неорганических примесей. Так, в том ато продукт ах при плохой промывке томатов перед переработкой или в картофельном крахмале при недостаточной промывке клубней содержится повышенное количество золы за счет посторонних минеральных примесей.
Кальций в организме человека находится в составе костной ткани и зубов - около 99 %. Остальная часть кальция входит в состав крови в форме ионов и в связанном с белками и другими соединениями состоянии.
Суточная потребность взрослого человека в кальции составляет 0,8-1,0 г. В повышенных количествах кальция нуждаются беременные и кормящие женщины, до 1,5-2 г в сутки, а также дети, в организме которых кальций усиленно используется на образование костей. Недостаток кальция вызывает в организме деформацию скелета, ломкость костей и атрофию мышц. Кальций характеризуется той особенностью, что даже при его недостатке в пище он продолжает выделяться из организма в значительных количествах.
В пищевых продуктах кальций встречается в форме хлористых фосфорнокислых, щавелевокислых солей, а также в соединении с жирными кислотами, белками и др.
Все соединения кальция, за исключением СаС!а трудно растворимы в воде, а поэтому плохо усваиваются
организмом человека. Нерастворимые соединения кальция частично переходят из продуктов в раствор в желудке под действием соляной кислоты желудочного сока. Усвояемость кальция пищевых продуктов организмом человека зависит в значительной степени от наличия в пище фосфатов, жиров, соединений магния и др. Так, усвояемость кальция наиболее высокая при соотношении в пище кальция и фосфора I ; 1,5 или 1: 2. Повышенное против указанных соотношений количество фосфора в пище приводит к резкому снижению усвояемости кальция. Неблагоприятное влияние на усвоение организмом человека кальция также оказывает избыток магния. Резко отрицательное влияние на усвояемость кальция оказывают соединения кальция с инозитфосфорной кислотой, которая содержится в значительных количествах в зерне злаковых и продуктах его переработки.
Очень важную роль в усвоении кальция играет витамин D, который содействует переходу солей кальция и фосфора из кишечника в кровь и отложению в костях в виде фосфорнокислого кальция.
Содержание кальция в некоторых пищевых продуктах следующее (мг%): в мясе тощем - 7; в яйцах - 54; в молоке - 118; в сыре - 930; в твороге - 140; в крупе овсяной - 65; в муке пшеничной - 15; в рисе - 9; в яблоках - 7; в апельсинах - 45; в орехах грецких -89; в свекле - 29; в капусте цветной - 89; в капусте белокочанной - 45; в моркови - 56; в картофеле - 14. Из приведенных данных видно, что наиболее важным источником кальция для человека являются молочные продукты. Кальций молочных продуктов, а также овощей и фруктов относится к легкоусвояемым соединениям.
Магния в теле человека в 30-35 раз меньше, чем кальция, но он имеет очень важное значение. Большая часть магния находится в костной ткани. Особая роль принадлежит магнию в хлорофиллоносных растениях, где он входит в состав молекулы хлорофилла. Как и кальций, магний образует труднорастворимые соединения. Особенно трудно усваивается магний в присутствии иона ЬО$.
Содержание магния в некоторых пищевых продуктах следующее (мг%): в фасоли - 139; в крупе овсяной - 133; в горохе - 107; в пшене - 87; в хлебе пшеничном - 30; в картофеле - 28; в моркови - 21; в капусте белоко-!анной - 12; в яблоках - 8; в лимонах - 7; в говядине - 15; в яйцах - 11; в молоке - 12. Следовательно, 2* 35магний содержится в наибольших количествах в зерно- , бобовых продуктах.
Потребность взрослого человека в магнии составляет 400 мг в сутки.
Натрий широко встречается в пищевых продуктах, особенно животного происхождения. Основным источником натрия для организма человека является NaCt (поваренная соль). Натрий играет важную роль в процессах внутриклеточного и межтканевого обменов. Около 90 % осмотического давления плазмы крови зависит от содержания в ней NaCI. Обычно в литре плазмы крови человека растворено 3,3 г натрия. NaC! играет также важную роль в регулировании водного обмена организма. Ионы натрия вызывают набухание коллоидов тканей и тем самым способствуют задержке в организме связанной воды. Из организма NaC! выделяется главным образом с мочой и потом. При усиленной работе и потреблении жидкостей человек теряет до 3-5 л пота, который на 99,5 % состоит из воды. В сухом веществе пота главную часть составляет NaGI.
Поваренная соль, поступающая в организм человека с пищей, пополняет расход NaCI в крови и используется для образования соляной кислоты желудочного сока, а также для синтеза панкреатической железой NaHCO3. Присутствием NaHCO3 объясняется щелочная реакция поджелудочного сока, что является необходимым для расщепления белков пищи ферментом трипсином.
Суточная потребность взрослого человека в натрии составляет 4-6 г, что соответствует 10-15 г поваренной соли. Обычные пищевые рационы населения содержат достаточные количества натрия, так как в пищу добавляется поваренная соль.
Калий постоянно и в значительных количествах присутствует в пищевых продуктах, особенно растительного происхождения, В золе растений содержание калия иногда более 50 % ее массы.
В организме человека калий участвует в ферментативных реакциях, образовании буферных систем, предотвращающих сдвиги реакции среды. Калий уменьшает
водоудерживающую способность белков, снижая их гидро-(Ьильность, и тем самым способствует выведению из организма воды, а также натрия. Поэтому калий может рассматриваться как некоторый физиологический антагонист натрия.
Суточная потребность взрослого человека в калии составляет 3-5 г.
Железо широко распространено в природе. Обычно почти все естественные пищевые продукты содержат железо, но в малых количествах.
В организмах человека и животных железо входит в состав важнейших органических соединений - гемоглобина крови, миоглобина, некоторых ферментов - ка-талазы, пероксидазы, цитохромоксидазы и др. В состав гемоглобина крови входит 2А, железа организма. Заметное количество железа находится в селезенке и печени. Железо обладает способностью накапливаться в организме. Гемоглобин в крови в процессе жизнедеятельности разрушается, а освобожденное при этом железо может вновь использоваться организмом для образования гемоглобина.
Железо, входящее в состав плодов и овощей, хорошо усваивается организмом человека, тогда как большая часть железа зерновых продуктов находится в неусвояемой для организма форме.
Суточная потребность взрослого человека з железе составляет 15 мг.
л л о р входит в состав естественных пищевых продуктов в небольших количествах. Продукты растительного происхождения содержат мало хлора, а животного происхождения - несколько больше. Так, содержание хлора в говядине составляет 76 мг%, в молоке- 106, в яйцах -
37106, в сыре - 880, в пшене - 19, в картофеле - 54, в яблоках - 5 мг%.
Содержание хлора значительно в крови и других жидкостях организма, а также в коже, легких, почках. Хлор в организме находится в ионизированном состоянии в виде анионов солей натрия, калия, кальция, магния, марганца. Соединения хлора пищевых продуктов хорошо растворимы и легко всасываются в кишечнике человека. Анионы хлора вместе с катионами натрия играют важную роль в создании и регулировании осмотического давления крови и других жидкостей организма. Соли хлора обеспечивают образование соляной кислоты слизистой оболочкой желудка.
Основную потребность в хлоре человек удовлетворяет за счет хлористого натрия, который добавляется в пищу в виде соли.
Общее количество хлористого натрия в теле человека обычно составляет 10-15 г, но при употреблении пищи, богатой солями хлора, содержание хлора в организме человека может достигать большего количества. Суточная потребность человека в хлоре составляет 5-7 г.
Сера в наибольших количествах содержится в продуктах из хлебных злаков, бобовых, молочных продуктах, мясе, рыбе и особенно в яйцах. Она входит в состав почти всех белков тела человека и особенно ее много в аминокислотах - цистине, метионине. Обмен серы в организме в основном представляет собой ее превращения в указанных аминокислотах. Она участвует также в образовании витамина Вг (тиамина), инсулина и некоторых других соединений. Много серы в протеиноидах опорных тканей, например в кератине волос, ногтях и т. д.
При окислении в организме соединений значительная часть серы выделяется с мочой в виде солей серной кислоты.
Суточная потребность взрослого человека в сере при умеренной работе составляет около 1 г.
Йод содержится в теле здорового человека массой 70 кг в количестве примерно 25 мг. Половина этого количества находится в щитовидной железе, а остальная часть - в мышечной и костной тканях и в крови. Йод неорганических соединений в щитовидной железе заменяется органическими соединениями - тироксином, ди-йодтироксином, трийодтироксином. Йод быстро усваивается щитовидной железой и через несколько часов после поступления в нее превращается в органические
соединения. Эти соединения стимулируют обменные процессы в организме. При поступлении в организм с пищей недостаточного количества йода нарушается деятельность щитовидной железы и развивается тяжелое заболевание, называемое эндемическим зобом.
Наибольшее количество йода содержится в растительных и животных продуктах приморских районов, где он сосредоточен в морской воде, воздухе и почве приморских районов. В растениях и организмах животных горных или отдаленных от морского побережья районов йода накапливается мало.
Содержание йода в зерновых продуктах, овощах, пресноводной рыбе не превышает 5-8 мкг на 100 г сырого продукта. Более высоким содержанием йода отличаются говядина, яйца, масло, фрукты. Морская капуста , морские рыбы и рыбий жир содержат наибольшее количество йода. В плодах фейхоа, произрастающих на Черноморском побережье Грузии, накапливается до 390 мкг йода на 100 г плодовой массы, что намного превышает содержание этого элемента в других плодах и овощах.
В районах, где в пищевых продуктах содержится недостаточное количество йода, к пищевой поваренной соли добавляют йодистый калий из расчета 25 г К1 на тонну поваренной соли. При нормальном питании человек потребляет с йодированной солью в сутки 200 мкг йода. Однако при хранении йодированной соли йод постепенно улетучивается, поэтому через 6 месяцев йодированную соль реализуют как обычную поваренную.
Суточная потребность человека в йоде составляет 100-260 мкг.
Фтор играет важную роль в пластических процессах при образовании костной ткани и зубной эмали. Наибольшее количество фтора сосредоточено в костях - 200- 490 мг/кг и зубах - 240-560 мг/кг.
Вода, по-видимому, является основным источником поступления фтора в организм человека, причем фтор Доды усваивается лучше, чем фтор пищевых продуктов. Содержание фтора в питьевой воде колеблется от 1 до 1.5- мг/л. Недостаток фтора в воде часто оказывает влия-
39нне на развитие заболевания зубов, известного под названием кариеса. Избыток же фтора в воде вызывает заболевание флюорозом, при котором нарушается нормальнее строение зубов, на эмали появляются пятна и увеличивается хрупкость зубов. От недостатка или избытка фтора особенно страдают дети.
Суточная потребность человека во фторе пока не установлена. Полагают, что оптимальное для здоровья количество фтора в питьевой воде должно быть 0,5- 1,2 мг/л.
Медь в животном организме наряду с железом играет важную роль в процессах кроветворения, стимулирует окислительные процессы и тем самым связана с обменом железа. Она входит в состав ферментов (лактазы, аскорбинатоксидазы, цитохромоксидазы и др.) в качестве металлокомпонента.
В растениях медь усиливает окислительные процессы, ускоряет рост и повышает урожайность многих сельскохозяйственных культур.
В тех небольших количествах, в которых медь содержится в естественных продуктах, она не приносит организму человека вреда. Но повышенные количества меди могут вызвать отравление. Так, одновременный прием 77-120 мг меди может вызвать тошноту, рвоту, а иногда и понос. Поэтому содержание меди в пищевых продуктах регламентируется действующими положениями Министерства здравоохранения СССР. На 1 кг продукта в зависимости от содержания в нем сухих веществ допускается от 5 до 30 мг меди. Так, в концентрированной томате-пасте содержание меди не должно превышать 30 мг/кг, в томате-пюре - 15-20, в овощных консервах - 10, в варенье и повидле - 10, во фруктовых компотах - 5 мг/кг.
Медь может попадать в пищевые продукты при их изготовлении - с медных частей аппаратуры, при обработке виноградников ядохимикатами, содержащими медь, и т. д.
Суточная потребность взрослого человека в меди составляет 2 мг.
Цинк содержится во всех тканях животных и растений. При недостатке цинка в организмах молодых жй-
вотных задерживается их рост, а при его недостатке в почве возникают заболевания многих растений, что нередко приводит к их гибели.
Цинк входит в состав ряда ферментов, и особенно важна его роль в молекуле фермента карбоангидразы, участвующей в связывании и выведении из животного организма углекислоты. Цинк необходим для нормальной функции гормонов гипофиза, надпочечников и поджелудочной железы. Он оказывает также влияние на жировой обмен, усиливая расщепление жиров и предупреждая ожирение печени.
Цинк в пищевых продуктах в повышенных количествах может служить причиной отравлений. Кислые и жировые продукты растворяют металлический цинк, и поэтому приготовление или хранение пищевых продуктов в цинковой аппаратуре или посуде недопустимо. Отравление цинком подобно отравлению медью, но более выражено и сопровождается жжением и болью во рту и желудке, рвотой, поносом и сердечной слабостью. Цинковая посуда допускается только для хранения холодной питьевой воды, так как в этом случае растворимость цинка ничтожно мала.
Суточная потребность взрослого человека в цинке составляет 10-15 мг. Повышенная потребность в цинке наблюдается в период роста и полового созревания. При нормальном питании человек получает достаточное количество цинка с пищевыми продуктами.
Свинец встречается в животных и растительных продуктах в очень малых количествах. Так, в яблоках, грушах, винограде, землянике содержание свинца составляет около 0,1 мг на 1 кг продукта, в молоке - 0,8, в мясе - 0,05, в осетрине - 0,06 мг на 1 кг.
Свинец является ядовитым для человека металлом, обладает способностью аккумулироваться в организме, главным образом в печени, и вызывать тяжелые хронические отравления.
При ежедневном употреблении с пищей 2-4 мг свинца через несколько месяцев могут обнаружиться признак:» свинцового отравления.
41Загрязнение пищи свинцом может быть от посуды, припоев, глазури, оборудования, а также от инсектицидов, содержащих свинец. Чаще всего свинцовые отравления возникают при хранении пищевых продуктов в кустарной глиняной посуде, недостаточно хорошо покрытой свинцовой глазурью.
Ввиду большой ядовитости содержание свинца в пищевых продуктах не допускается.
Олово в пищевых продуктах обнаруживается в незначительных количествах. Так, в печени быка и барана найдено 0,14 мг/кг олова, в почках - 0,003, в легких - 0,63, в мозгу - 0,019 мг/кг.
Олово не является таким ядовитым металлом, как свинец, цинк или медь, поэтому допускается в ограниченных количествах в аппаратуре пищевых предприятий, а также для лужения поверхности жести, из которой готовят консервные банки, предохраняя ее от коррозии. Однако нередко при длительном хранении консервов в жестяных банках происходит взаимодействие массы продукта с оловянным покрытием жести, вследствие чего образуются оловянные соли органических кислот. Этот процесс происходит особенно активно, когда в жестяной банке находятся продукты с повышенной кислотностью - плоды, рыбные и овощные консервы в томатном соусе и др. При длительном хранении содержание олова в консервах может значительно возрастать. Особенно быстро увеличивается содержание олова в продуктах, находящихся в открытых металлических банках, покрытых оловом.
Для усиления защиты жестяной консервной банки от коррозии на поверхность олова дополнительно наносят специальные кислотоустойчивые лаки или эмаль либо создают на поверхности жести тонкую пленку устойчивых окислов олова.
Марганец широко распространен в продуктах животного и растительного происхождения. Он принимает активное участие в образовании многих ферментов, формировании костей, процессах кроветворения и стимул и-* рует рост. В растениях марганец усиливает процесс фотосинтеза и образования аскорбиновой кислоты.
Растительные продукты в большинстве случаев богаче марганцем, чем животные. Так, содержание марганца в злаковых продуктах достигает 1-15 мг на 1 кг, в листо-
вых овощах - 10-20, в плодах - 0,5-1, в молоке - 0,02-0,03, в яйцах -0,1-0,2, в печени животных - 2,65-2,98 мг на 1 кг.
При недостатке в почве марганца растения заболевают и плохо развиваются, снижается урожай плодов, овощей и других культур. Добавка в почву микроудобрений, содержащих марганец, способствует повышению урожая.
Суточная потребность взрослого человека в марганце составляет 5-10 мг в сутки.
Радиоактивные изотопы присутствуют в организме человека, они непрерывно поступают и выводятся из организма. Существует равновесие между поступлением в организм радиоактивных соединений и выведением их из организма. Во всех пищевых продуктах содержатся радиоактивные изотопы калия (К40), углерода (С14), водорода (Н3), д также радия с продуктами его распада.
Наибольшая концентрация приходится на калий (К40). Изотопы участвуют в обмене веществ наряду с нерадиоактивными.
Полагают, что в течение ближайшего в геологическом отношении времени в интенсивности радиации на Земле не было больших изменений, поэтому в животном и растительном мире выработалась своего рода невосприимчивость к этим уровням радиации. Но к повышенным концентрациям живые организмы весьма чувствительны. Небольшие концентрации повышают рост живых организмов, большие - вызывают появление активных радикалов, вследствие чего происходит нарушение жизнедеятельности отдельных органов и тканей, а также всего организма в целом.
При атомных взрывах на поверхность Земли выпадают радиоактивные изотопы, которые загрязняют атмосферу, воду, почву и растения. Через пищу, атмосферу и воду радиоактивные изотопы попадают в организм человека.
Установлено, что при обработке излучениями радиоактивных изотопов пищевых продуктов увеличивается срок их хранения, задерживается прорастание картофеля. Но обычно у подвергшейся облучению пищи может появиться специфический запах и вкус и не исключено, что могут образоваться токсические вещества. Для определения безвредности таких продуктов требуются длительные опыты.
Контрольные вопросы
Какие химические элементы относятся к макроэлементам?
Какие функции выполняют минеральные вещества в организме человека?
Какова роль кальция в организме человека?
Какие химические элементы относят к микроэлементам и каковы их функции в организме человека?
Какую роль играет железо в организме человека и в каких пищевых продуктах оно содержится?
Какие последствия могут наблюдаться при дефиците иода в организме и какэтого можно избежать?
Какие виды технологической обработки сырья и пищевых продуктов способствуют потере минеральных веществ?
Приведите примеры взаимодействия некоторых микроэлементов и витаминов.
Какие методы определения содержания макро- и микроэлементов вы знаете?
Кукушкин лен размножается: зооспорами;
семенами при неблагоприятных условиях;
спорами; +
апланоспорами.
- Листья земляники:
непарноперистосложные;
тройчатосложные; +
тройчатосложные, однолисточковые;
сложные однолисточковые. Рабочие пчелы это:
бесполые особи;
самки с недоразвитыми органами размножения; +
самцы с недоразвитыми органами размножения;
самцы и самки с нормально развитыми половыми органами, но временно не размножающиеся. Пищеварение у коралловых полипов:
только полостное;
только внутриклеточное;
полостное и внутриклеточное; +
полостное, внутриклеточное и наружное. Крылоногие моллюски, обладающие способностью светиться в темноте, могут входить в состав:
бентоса;
нейстона;
фитопланктона;
зоопланктона. + Цикл развития мясной мухи впервые описал:
Антон Левенгук;
Франческо Реди; +
Анри Фабр;
Луи Пастер. У гусениц бабочек имеется:
три пары грудных ножек;
три пары грудных ножек и пять пар брюшных ложных ножек; +
восемь пар ложных ножек;
конечности отсутствуют. Кровеносная система у ланцетника:
незамкнутая;
замкнутая, имеется один круг кровообращения; +
замкнутая, имеется два круга кровообращения;
отсутствует. Выберите правильные суждения:
- Выберите правильные суждения:
- У круглоротых пищеварительный тракт имеет:
форму прямой трубки;
печеночный вырост;
пилорические выросты;
спиральный клапан. + Из рыб отряда Осетровых не является проходным видом:
белуга;
севрюга;
стерлядь; +
осетр. Слюнные железы в ходе эволюции позвоночных впервые появляются у:
двоякодышащих рыб;
земноводных; +
пресмыкающихся;
млекопитающих. Из рыб отряда Тресковых живет и нерестится только в пресных водоемах:
треска;
пикша;
налим; +
минтай. Происхождение крыла птицы от свободной передней конечности свойственной четвероногим позвоночным наглядно иллюстрируется на примере птенцов:
страуса;
киви;
гоацина; +
пингвина. На аэродинамические свойства птицы в полете не влияют перья:
маховые;
пуховые; +
рулевые;
контурные. Среди птиц стереоскопическое зрение в наибольшей степени развито у видов:
насекомоядных;
зерноядных;
плотоядных; +
планктоноядных.
Гликокаликс животных клеток образуют:
белки и липиды;
белки и нуклеотиды;
белки и углеводы; +
углеводы и нуклеотиды.
Процесс, с помощью которого дизентерийная амеба поглощает эритроциты:
осмос;
пиноцитоз;
фагоцитоз; +
облегченная диффузия.
Останки питекантропа впервые были обнаружены в:
Южной Африке;
Австралии;
Центральной Азии;
Юго-Восточной Азии. +
Наиболее древним, из названных ископаемых предков человека, является:
неандерталец;
питекантроп;
австралопитек; +
кроманьонец.
Органоиды, имеющиеся в клетках и прокариот и эукариот:
эндоплазматическая сеть;
митохондрии;
лизосомы;
рибосомы. +
Основными компонентами хроматина ядра эукариот являются:
ДНК и РНК;
РНК и белки;
ДНК и белки; +
ДНК и липиды. Микротрубочки не обеспечивают
:
поддержание формы клетки;
изменение формы клетки; +
перемещение органелл;
движение хромосом при делении клетки. Клеточные белки, предназначенные для секреции, сортируются и упаковываются в:
лизосомах;
эндосомах;
эндоплазматическом ретикулуме;
транс-сети Гольджи. +
Местом расположения фермента АТФ-синтетазы в митохондриях является:
матрикс;
межмембранное пространство;
наружная мембрана;
внутренняя мембрана. +
Окисление органических соединений до СО 2 в митохондриях происходит:
в матриксе; +
в межмембранном пространстве;
на наружной мембране;
на внутренней мембране.
В состав антикодона входит:
один нуклеотид;
два нуклеотид;
три нуклеотида; +
четыре нуклеотида.
Конечным акцептором электронов в процессе клеточного дыхания является:
НАДН;
вода;
кислород; +
АТФ.
Свойство генетического кода, повышающее надежность хранения и передачи генетической информации:
триплетность;
универсальность;
избыточность; +
отсутствие «знаков препинания».
Ионы магния входят в состав:
гемоглобина;
инсулина;
хлорофилла; +
тироксина. Молекулы РНК, способные проявлять каталитическую активность, называются:
рибонуклеазами;
рибосомами;
рибозимами; +
рибонуклеотидами. Макроэргическими называют соединения,:
характеризующиеся наличием ковалентных связей с большой энергией;
при разрушении определенных связей в которых освобождается большое количество свободной энергии; +
синтез которых происходит с затратой большого количества энергии;
которые при сжигании дают много тепла.
В процессе фотосинтеза источником кислорода – побочного продукта является:
рибулозобисфосфат;
глюкоза;
вода; +
углекислый газ.
Развитие нитрифицирующих бактерий приводит к:
подкислению среды; +
подщелочению среды;
нейтрализации среды;
не влияет на рН среды.
Ацидофилин образуется в результате сбраживания молока:
молочнокислыми бактериями; +
дрожжами;
смешанной культурой молочнокислых бактерий и дрожжей;
смешанной культурой молочнокислых и пропионовокислых бактерий.
Из названных заболеваний вызывается вирусом:
холера;
оспа; +
чума;
малярия.
Из компонентов растительной клетки вирус табачной мозаики поражает:
митохондрии;
хлоропласты; +
ядро;
вакуоли.
В наш стремительный век все находятся под прессом напряжения. Стресс – один из основных факторов агрессии окружающей среды. Он наносит непоправимый ущерб организму. В организме человека, испытывающего стресс, происходят разрушительные процессы. К примеру, дефицит жизненно важного микроэлемента магния возрастает в 10 раз. Восполнить чреватый последствиями дефицит возможно не только медикаментозно. Справиться с этой проблемой могут помочь продукты, содержащие магний.
Недостаточность магния, наряду с дефицитом йода, и цинка, чрезвычайно распространена среди населения развитых стран. В последнее десятилетие ее все чаще выявляют у детей подросткового возраста. У них, вследствие интенсивного роста и чрезмерных нагрузок, потребность в магнии огромна, а поступление его в организм с водой и пищей явно недостаточно.
Что же это за микроэлемент, и почему все страдают от его нехватки?
Количественное содержание магния в теле человека - четвертое среди жизненно важных микроэлементов, его внутриклеточное содержание - на втором месте после калия.

Магний - активный участник подавляющего большинства биологических реакций в теле человека. Он ответственен за состояние клеточных мембран, принимает участие во всех процессах преобразования энергии, в транспортировке свободных радикалов и расщеплении продуктов их окисления. Почти 80-90% внутриклеточного магния комплексно связано с АТФ. Ионы магния входят в состав более трехсот ферментов, без его участия невозможны гликолиз и синтез ДНК и РНК.

Необходимый уровень этого микроэлемента в нашем организме требуется, прежде всего, для:
- обеспечения энергией всех биохимических реакций;
- обеспечения нервно-мышечной проводимости;
- стабилизации тонуса гладкой мускулатуры стенок сосудов, ЖКТ и мочевого пузыря;
- эффективности обменных процессов в клетках мышцы ;
- ограничения выработки альдостерона и катехоламинов при стрессе, что предотвращает гипертонию;
- состоятельности иммунной системы, так как при его дефиците резко снижается уровень нейтрофилов и моноцитов, катастрофически падает активность В - и Т- клеток, то есть резко падает устойчивость организма к инфекциям;
- поддержания достаточного уровня кальция в костной ткани, для постоянного ее обновления. Достаточно продолжительный дефицит магния, вместе с дефицитом кальция и гиподинамией, являются пусковым механизмом возникновения остеохондроза позвоночника.
Как распознать нехватку магния в организме?
Когда магния не хватает, появляются головные боли, усталость и слабость, трудности в засыпании, чувство разбитости по утрам. Скованность и судорожные подергивания в мышцах, тики, спазмы и икота тоже могут быть обусловлены нехваткой магния. Все эти симптомы нивелируются восполнением его недостатка в организме.

При нехватке магния блокируется передача нервных импульсов. Человек становится раздражительным и легковозбудимым, гиперчувствительным к внешним раздражителям. Он вздрагивает при малейшем звуке, страдает от яркого света. Зачастую нехватка магния вызывает нарушения ритма сердца, гипертонию. Часто дефицит магния проявляется запорами, может отмечаться ломкость ногтей.
Какова норма магния в рационе нашего питания?
Последние медицинские исследования дают следующие рекомендации о суточном потреблении магния с пищей:
- 400 - 420 миллиграмм для мужчин;
- 310 - 320 миллиграмм для женщин.
Продукты питания, содержащие магний

Магний попадает в наш организм непосредственно с пищей и водой. В кишечнике всасывается до 40-50% количества магния, поступающего с едой.
Предельно насыщена магнием растительная пища - овощи, листовые, бобы и орехи, а также крупы - гречневая, перловая, овсяная и пшено. Богата магнием фасоль и другие стручковые овощи. В приготовленных на пару или в сваренных в минимальном объеме воды овощах, таких, как шпинат, свекла, кольраби, магния тоже достаточно, но от продолжительной варки его количество резко понижается.

Достаточное количество жизненно важного элемента содержат какао, чечевица, семя льна и кунжута, проросшие зерна пшеницы.

Употребление в пищу подсолнечника, богатого магнием в 6 раз больше, чем ржаной хлеб, позволяет организму одновременно получать дозу . Полноценным витаминным комплексом обладают грецкие орехи, которые насыщены, кроме магния, фитонцидами, калием, фосфором и кальцием. Добавление в пищу шоколада, предельно богатого, кроме магния, марганцем, способствует борьбе со стрессом. Употребление в пищу пророщенной пшеницы, одного из богатейших магнием продуктов, дает стойкий и длительный результат. Пшено также чрезвычайно насыщено этим необходимым элементом. Кроме этого, оно стимулирует работу системы кроветворения, останавливает развитие опухолей, обладает мочегонным действием. Богата солями магния морская капуста, она содержит, кроме этого, достаточно фосфора, калия, йода, железа. Абрикосы тоже насыщены магнием, а это может укрепить память, поднять работоспособность и повысить устойчивость к эмоциональным нагрузкам.