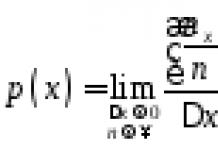Конспект урока «Расчёты по химическим уравнениям»
1. Проверка домашнего задания
В качестве домашнего задания вам было предложено расставить коэффициенты в уравнениях реакций. Можно посмотреть на перемене выполненную работу. Ошибки наверняка будут. Все ли получилось, есть ли у кого-то вопросы? Пусть расскажут о проведённом домашнем опыте.
2. Объявление темы и актуализация знаний
Тема сегодняшнего урока – расчеты по химическим уравнениям. Для начала, давайте вспомним все то, что сегодня нам может пригодиться. С химическими уравнениями мы уже сталкивались на прошлой лабораторной работе, в домашнем задании, еще раньше – в теме бинарные соединения. Давайте вспомним определение уравнения химической реакции.
(это условная запись химической реакции с помощью химических формул и коэффициентов.)
Замечательно.
При производстве каких-либо соединений нужно знать, сколько взять исходных веществ для получения требуемой массы продукта реакции. Для этого составляют уравнение протекающей химической реакции, а при расчётах масс учитывают молярные массы веществ, а при расчётах объёмов газов учитывают величину молярного объёма газов.
Кто помнит значение молярного объема газов при нормальных условиях? (22,4 л/моль)
И что это за нормальные условия? (давление 101,3 кПа и температура 0 о С)
То есть при данных условиях 1 моль ЛЮБОГО газа занимает объем 22,4 л.
Собственно, для того, чтобы решать задачи, нам необходимо вспомнить несколько величин:
Молярная масса – М (г/моль)
Количество вещества – n (моль)
Объём – V (л)
Лучше так: вы помните, что молярная масса численно равна относительной атомной массе или относительной молекулярной массе вещества. Для этого нужно использовать таблицу Менделеева, где в нижней части каждой «ячейки» указана относительная атомная масса. Не забывая правила округления, целое значение этой массы мы и используем в расчётах.
Химия – наука очень четкая, логичная и последовательная, потому удобно будет для решения задач использовать АЛГОРИТМ, который приведен в учебнике. Это универсальная последовательность действий, которая используется для решения любой задачи данного типа.
Откройте, пожалуйста, учебник и давайте все вместе ознакомимся с алгоритмом.
(тут мы все дружно открываем учебники, кто-то один, возможно, я, читает алгоритм, остальные – следят, чтобы понимать, что им сейчас предстоит делать)
Звучит объемно, но, надеюсь, не слишком непонятно. Попробуем разобраться на примере.
Задача 1. Для получения водорода алюминий растворяют в серной кислоте: 2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 (Первый пункт нашего алгоритма). Для реакции взяли 10,8 г алюминия. Вычислите массу затраченной серной кислоты.
Дано: m (Al) = 10,8 г | Решение: m=10,8 г m - ? 2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 М=27г/моль М=98г/моль Здесь можно упомянуть, что фактически в реакцию вступает не 2 атома алюминия и 3 молекулы кислоты, а порция атомов алюминия и порция молекул кислоты. Эту порцию в химии называют коротким словом «моль». n=2 моль n=3 моль m = M ∙ n m=54 г m=294 г Расчёт по пропорции: |
||||
m (H 2 SO 4 ) - ? |
|||||
10,8 г | |||||
54 г | 294 г | ||||
10,8 г ∙ 294 г | |||||
54 г | |||||
Х = 58,8 г Ответ: m (H 2 SO 4 ) = 58,8 г |
|||||
Вот и все решение задачи. Есть вопросы? Давайте проговорим ход решения еще разок:
Составили уравнение
Над веществами подписали то, что ЗНАЕМ и то, что ХОТИМ НАЙТИ
Под формулами записали молярную массу, количество вещества и стехиометрическую массу вещества (лучше указать «массу по таблице Менделеева»)
Составили пропорцию
Решили пропорцию
Записали ответ
Решим похожую задачу, но уже с газообразными веществами (здесь мы будем использовать не молярную массу вещества, а что?...молярный объем)
Задача 2. 25 граммов цинка растворяют в соляной кислоте, в ходе химической реакции выделяется газ – водород. Рассчитайте объем выделяющегося водорода.
Дано: m (Zn) = 10,8 г | Решение: m=25 г V - ? Zn + 2HCl → ZnCl 2 + H 2 М=65 г/моль V m =22.4 л/моль n=1 моль n=1 моль m=65 г V=22.4 л Расчёт по пропорции: |
||||
m (HCl) - ? |
|||||
25 г | |||||
65 г | 22,4 л | ||||
25 г ∙ 22,4 л | |||||
65 г | |||||
Х = 8,61 л Ответ: V(H 2 ) = 8,61 л |
|||||
Проверим, как вы усвоили материал. Используя все тот же алгоритм, решите задачу:
НЕ ФАКТ, ЧТО ВЫ УСПЕЕТЕ:
При реакции с углем оксидов Fe2O3 (первый вариант) и SnO2 (второй вариант) получили по 20 г Fe и Sn. Сколько граммов каждого оксида было взято?
Обратите внимание, что сейчас мы рассчитываем массу исходных веществ, а не продуктов реакции)
(пусть каждый решит в тетради и выборочно попрошу показать решение, уравнение запишем все вместе на доске, а прорешать каждый попробует сам)
Fe2O3 + 3C = 2Fe + 3CO m(Fe2O3)= 160*20/2*56= 28,5 г
SnO2+C=Sn+CO2 m(SnO2)= 20*151/119= 25,38 г
Домашнее задание: изучить материал учебника с. 146-150, решить задачу
Какую массу оксида кальция и какой объём углекислого газа (н.у.)
можно получить при разложении карбоната кальция массой 250 г? НУЖНО ДАТЬ ШКОЛЬНИКАМ ГОТОВОЕ УРАВНЕНИЕ ДЛЯ ОФОРМЛЕНИЯ ЭТОЙ ЗАДАЧИ
"Не для муки, а для науки."
(Народная мудрость)
Расчеты по уравнениям химических реакций
Классификация химических реакций. Реакции соединения, разложения, замещения, двойного обмена, окислительно-восстановительные реакции. Уравнения химических реакций. Подбор стехиометрических коэффициентов в уравнениях реакций. Расчеты по уравнениям реакций. Определение количества вещества и массы реагентов и продуктов. Определение объема газообразных реагентов и продуктов. Теоретический и практический выход продукта реакции. Степень чистоты химических веществ.
Примеры решения типовых задач
Задача 1. При рентгеноскопическом исследовании организма человека применяют так называемые рентгеноконтрастные вещества. Так, перед просвечиванием желудка пациенту дают выпить суспензию труднорастворимого сульфата бария, не пропускающего рентгеновское излучение. Какие количества оксида бария и серной кислоты потребуются для получения 100 сульфата бария?
Решение.
BaO + H 2 SO 4 = BaSO 4 + H 2 O
m (BaSO 4) = 100 г; M (BaSO 4) = 233 г/моль
n (BaO) = ?
n (H 2 SO 4) = ?
В соответствии с коэффициентами уравнения реакции, которые в нашем случае все равны 1, для получения заданного количества BaSO 4 требуются:
n (BaO) = n (BaSO 4) = m (BaSO 4) / M(BaSO 4) = 100: 233
[г: (г/моль)] = 0,43 моль
n (H 2 SO 4) = n (BaSO 4) = m (BaSO 4) / M (BaSO 4) = 100: 233
[г: (г/моль)] = 0,43 моль
Ответ. Для получения 100 г сульфата бария требуются 0,43 моль оксида бария и 0,43 моль серной кислоты.
Задача 2. Прежде чем вылить в канализацию жидкие отходы лабораторных работ, содержащие соляную кислоту, полагается их нейтрализовать щелочью (например, гидроксидом натрия) или содой (карбонатом натрия). Определите массы NaOH и Na 2 CO 3 , необходимые для нейтрализации отходов, содержащих 0,45 моль HCl. Какой объем газа (при н.у.) выделится при нейтрализации указанного количества отходов содой?
Решение. Запишем уравнения реакций и условия задачи в формульном виде:
(1) HCl + NaOH = NaCl + H 2 O
(2) 2HCl + Na 2 CO 3 = 2NaCl + H 2 O + CO 2
n (HCl) = 0,45 моль; M(NaOH) = 40 г/моль;
M (Na 2 CO 3) = 106 г/моль; V M = 22,4 л/моль (н.у.)
n (NaOH) = ? m (NaOH) = ?
n (Na 2 CO 3) = ? m (Na 2 CO 3) = ?
V (CO 2) = ? (н.у.)
Для нейтрализации заданного количества HCl в соответствии с уравнениями реакций (1) и (2) требуется:
n (NaOH) = n (HCl) = 0,45 моль;
m (NaOH) = n (NaOH) . M (NaOH) = 0,45 . 40
[моль. г/моль] = 18 г
n (Na 2 CO 3) = n
m (Na 2 CO 3) = n (Na 2 CO 3) / M (Na 2 CO 3) = 0,225 . 106
[моль. г/моль] = 23,85 г
Для расчета объема углекислого газа, выделившегося при нейтрализации по реакции (2), дополнительно используется уравнение, связывающие между собой количество газообразного вещества, его объем и молярный объем:
n (CO 2) = n (HCl) / 2 = 0,45: 2 [моль] = 0,225 моль;
V (CO 2) = n (CO 2) . V M = 0,225 . 22,4 [моль. л/моль] = 5,04 л
Ответ. 18 г NaOH; 23,85 г Na 2 CO 3 ; 5,04 л CO 2
Задача 3. Антуан-Лоран Лавуазье открыл природу горения различных веществ в кислороде после своего знаменитого двенадцатидневного опыта. В этом опыте он сначала длительное время нагревал в запаянной реторте навеску ртути, а позже (и при более высокой температуре) - образовавшийся на первом этапе опыта оксид ртути(II). При этом выделялся кислород, и Лавуазье стал вместе с Джозефом Пристли и Карлом Шееле первооткрывателем этого важнейшего химического элемента. Рассчитайте количество и объем кислорода (при н.у.), собранный при разложении 108,5 г HgO.
Решение. Запишем уравнение реакции и условие задачи в формульном виде:
2HgO = 2Hg + O 2
m (HgO) = 108,5 г; M (HgO) = 217 г/моль
V M = 22,4 л/моль (н.у.)
V (O 2) = ? (н.у.)
Количество кислорода n (O 2), который выделяется при разложении оксида ртути(II), составляет:
n (O 2) = 1/2 n (HgO) = 1/2 m (HgO) / M (HgO) = 108,5 / (217 . 2}
[г: (г/моль)] = 0,25 моль,
а его объем при н.у. - V (O 2) = n (O 2) . V M = 0,25 . 22,4
[моль. л/моль] = 5,6 л
Ответ. 0,25 моль, или 5,6 л (при н.у.) кислорода.
Задача 4. Важнейшая проблема в промышленном производстве удобрений - получение так называемого "связанного азота". В настоящее время ее решают путем синтеза аммиака из азота и водорода. Какой объем аммиака (при н.у.) можно получить в этом процессе, если объем исходного водорода равен 300 л, а практический выход (z) - 43 %?
Решение. Запишем уравнение реакции и условие задачи в формульном виде:
N 2 + 3H 2 = 2NH 3
V (H 2) = 300 л; z(NH 3) = 43% = 0,43
V (NH 3) = ? (н.у.)
Объем аммиака V (NH 3), который можно получить в соответствии с условием задачи, составляет:
V (NH 3) практ = V (NH 3) теор. z(NH 3) = 2/3 . V (H 2) . z(NH 3) =
2/3 . 300 . 0,45 [л] = 86 л
Ответ. 86 л (при н.у.) аммиака.
Если приведенные здесь типовые задачи стали Вам совершенно понятны, приступайте к решению
Расчеты по химическим уравнениям
Закирова Олися Тельмановна –учитель химии.
9 класс
Цели урока: Сформировать знания о способах решения задач по химическим уравнениям: находить количество, массу и объём продуктов реакции по количеству, массе или объёму исходных веществ, Развивать умения анализировать, сравнивать, выделять главное, составлять план действия, делать выводы, навыки работы с текстом задачи, умение выбирать способ решения учебной задачи, умения составлять уравнения химических реакций. Воспитывать самостоятельность в принятии решений, умение оценить результаты.
Ход и содержание урока
I Организационный момент. Здравствуйте ребята. Сегодня, очень интересный урок по решению задач.
II. Актуализация знаний, умений, навыков.
Для того чтобы знать и понимать химию, надо не только усваивать материал, но и уметь применять полученные знания. Вы знаете признаки указывающие на протекание химических реакций, умеете составлять уравнения химических реакций.
1.Перечислите признаки химических превращений:
2.Установите соответствие.
4Al + 3O 2 = 2Al 2 O 3 а) уравнения реакций соединения
MgCO 3 = MgO + CO 2 б) уравнения реакций замещения
2HgO = 2Hg + O 2: в) уравнения реакций разложения
2Na + S=Na 2 S
Zn + Br 2 = ZnBr2
Zn + 2HCl = ZnCl 2 + H 2
Fe + CuSO 4 =FeSO 4 +Cu
III . Усвоение новых знаний. Для того чтобы решить расчетную задачу по химии, можно воспользоваться следующим алгоритмом - сделать пять шагов:
1. Составить уравнение
2. Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения
(только для чистых веществ, то есть не содержащих принеси). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала надо определить содержание чистого вещества.
3. Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакции.
4. Составить и решить пропорцию.
5. Записать ответ.
Приступаем к решению задач, применяя алгоритм
Вычисление объема вещества по известной массе другого вещества, участвующего в реакции
V(0 2)=?л(н.у.)
М(Н 2 О)=18 г/моль
Vm=22,4л/моль Запишем уравнение реакции. Расставим коэффициенты
2Н 2 О = 2Н 2 + О 2
Над формулой в уравнении реакции запишем найденное значение количества вещества, а под формулами веществ - стехиометрические соотношения, отображаемые химическим уравнением
0,5моль - х моль
2Н 2 О = 2Н 2 + О 2
2моль - 1моль
Вычислим количество вещества, массу которого требуется найти. Для этого составим пропорцию
![]()
откуда х = 0,25 моль
Найдем объем вещества, который требуется вычислить
V(0 2)=n(0 2) Vm
V(O 2)=0,25моль 22,4л/моль=5,6л (н. у.)
Ответ: 5,6 л
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
Вычислите массу кислорода, выделившегося в результате разложения
порции воды массой 9 г.
Найдем молярную массу воды и кислорода:
М(Н 2 О) = 18 г/моль
М(О 2) = 32 г/моль
Запишем уравнение химической реакции:
2Н 2 О = 2Н 2 + О 2
Над формулой в уравнении реакции запишем найденное значение количества вещества, а под формулами веществ -стехиометрические соотношения, отображаемые химическим уравнением
0,5моль х моль
2Н 2 О = 2Н 2 + О 2
2моль 1моль
Вычислим количество вещества, массу которого требуется найти.
Для этого составляем пропорцию
0,5моль = хмоль
2моль 1моль
откуда х = 0,25 моль Следовательно, n(O 2 )=0,25 моль
Найдем массу вещества, которую требуется вычислить
m(O 2)= n(O 2)*M(O 2)
m(O 2) = 0,25 моль 32 г/моль = 8 г
Запишем ответ
Ответ: m(О 2) = 8 г
I V .Закрепление изученного материала. Какой объем воздуха (н.у) потребуется для взаимодействия с 270 гр. , содержащего 20% примесей? Какое количество вещества оксида алюминия при этом получится?
V .Домашнее задание:
1 уровень Вычислите объем кислорода (н. у.), выделившегося в результате разложения порции воды массой 9 г.
2 уровень При рентгеноскопическом исследовании организма человека применяют так называемые рентгеноконтрастные вещества. Так, перед просвечиванием желудка пациенту дают выпить суспензию труднорастворимого сульфата бария, не пропускающего рентгеновское излучение. Какие количества оксида бария и серной кислоты потребуются для получения 100 сульфата бария?
3 уровень Прежде чем вылить в канализацию жидкие отходы лабораторных работ, содержащие соляную кислоту, полагается их нейтрализовать щелочью (например, гидроксидом натрия) или содой (карбонатом натрия). Определите массы NaOH и Na 2 CO 3 , необходимые для нейтрализации отходов, содержащих 0,45 моль HCl. Какой объем газа (при н.у.) выделится при нейтрализации указанного количества отходов содой?
С помощью стехиометрических коэффициентов схема химической реакции переходит в ее уравнение, которое в явном виде отражает закон сохранения количества атомов каждого вида при переходе от исходных веществ (реагентов) к продуктам реакции.
Стехиометрические коэффициенты позволяют установить связь между количествами участвующих в реакции веществ на основе следующего правила:
коэффициенты в химическом уравнении задают молярные пропорции (отношения), в которых вступают в реакцию исходные вещества (реагенты) и образуются продукты реакции.
Рассмотрим в качестве примера реакцию синтеза аммиака:
3H 2 + N 2 = 2NH 3 ,
для которой согласно приведенному правилу можно записать
где индексы «пр.» и «обр.» соответствуют количествам прореагировавших и образовавшихся веществ. Последнее соотношение можно представить в ином виде:
а) для веществ H 2 и N 2:
или в другой форме
 ;
;
б) для веществ H 2 и NH 3: или
или ;
;
в) для веществ N 2 и NH 3: или
или .
.
Легко видеть, что все пропорции можно объединить и записать в виде:
 =
= .
.
Последнее равенство является основным расчетным уравнением , связывающим количества прореагировавших веществ и образовавшихся продуктов реакции. При необходимости в это уравнение можно из условия задачи ввести массы и объемы участников реакции, используя обычные соотношения.
Например, для реакции
4FeS 2 (т) + 11О 2 = 2Fe 2 O 3 (т) + 8SO 2 (г)
основное расчетное уравнение имеет вид:
и если в него ввести обычно задаваемые в задачах для твердых веществ их массы, а для газов – объемы, то оно примет следующую форму:
Методика вычислений с использованием основного расчетного уравнения химической реакции включает в себя несколько общих моментов:
1) Прежде всего определяют опорное вещество, по количеству которого проводят весь последующий расчет. В условии задачи для него задана или масса, или объем, или концентрация, которые, в свою очередь, позволяют вычислить число молей опорного вещества. Как правило, это не составляет большого труда, а исключение относится к так называемым задачам на избыток и недостаток, когдаопорное вещество нужно выбрать издвух исходных. Дело в том, что при приготовлении реакционной смеси исходные вещества можно смешивать в любых пропорциях, но реагировать друг с другом они будут всегда в строго определенных пропорциях, которые устанавливают для них стехиометрические коэффициенты в уравнении химической реакции. В этих условиях вполне возможна ситуация, когда одно из исходных веществ прореагирует полностью, а часть другого останется не прореагировавшей и тогда говорят, что первое вещество взято в недостатке по отношению ко второму и, наоборот, второе вещество находится в избытке по отношению к первому. В данном случае в качестве опорного вещества следует выбрать исходное вещество, взятое в недостатке, поскольку именно его количество будет определять как окончание реакции, так и количества образующихся продуктов.
Как определить опорное вещество, если в задаче указаны данные (массы, объемы и др.) для обоих исходных веществ? Пусть в реакцию вступают два вещества А и В
аА + вВ → продукты реакции,
а исходные количества этих веществ 0 (А) и 0 (В) можно вычислить из условия задачи.
Для
ответа на поставленный вопрос нужно
сравнить два числа
 ,
где возможны три варианта:
,
где возможны три варианта:
I
вар.
 ,
тогда исходная реакционная смесь
называется стехиометрической и в
качестве опорного вещества может быть
выбрано любое из них – А или В;
,
тогда исходная реакционная смесь
называется стехиометрической и в
качестве опорного вещества может быть
выбрано любое из них – А или В;
II
вар.
 ,
тогда вещество А взято в избытке и
опорным будет вещество В;
,
тогда вещество А взято в избытке и
опорным будет вещество В;
III
вар.
 ,
тогда вещество В будет в избытке и
опорным является вещество А.
,
тогда вещество В будет в избытке и
опорным является вещество А.
Окончание необратимых химических реакций в первом варианте происходит в момент одновременного исчезновения обоих исходных веществ, а в двух других – в момент исчезновения вещества, взятого в недостатке, причем в конечной смеси веществ, наряду с продуктами реакции, будет присутствовать не прореагировавший остаток вещества, взятого в избытке.
2) Из основного расчетного уравнения вытекает простое правило определения числа молей вступивших в реакцию исходных веществ и образовавшихся продуктов по числу молей опорного вещества:
для определения числа молей прореагировавшего или образовавшегося в реакции вещества необходимо число молей опорного вещества разделить на его стехиометрический коэффициент и этот результат умножить на стехиометрический коэффициент определяемого вещества.
Для реакции 2Al + 6HCl = 2AlCl 3 + H 2 ,
где опорным веществом, например, является алюминий можно записать:



Определив количества интересующих нас веществ, легко рассчитать их массы, объемы и концентрации, то есть те характеристики участников химической реакции, которые фигурируют в условии задачи.
Таким образом, общая схема расчета по уравнению химической реакции может быть представлена в виде:
Необратимая реакция.
Пусть
 и
и начальные количества реагентов А и В и
начальные количества реагентов А и В и ,
т.е. вещество А взято в избытке, тогда
,
т.е. вещество А взято в избытке, тогда
a A + в В = с С + d D
|
(избыток) |
(недостаток) | |||||
|
окончание реакции: |
|
|
|
|||
Обратимая реакция.
В этом случае реакция заканчивается установлением химического равновесия и равновесная смесь содержит как продукты реакции, так и остаток исходных веществ. Пусть к моменту установления равновесия образовалось, например, х моль продукта С – это опорное вещество, то
a A + в В с С + d D
|
Начало реакции: |
|
| ||
|
Равновесие: |
|
|
|
|
Пример 1. Раствор, содержащий 20,0 г гидроксида натрия поглотил 6,72 л углекислого газа (н. у.). Определите продукты реакции и их количества.
При поглощении раствором щелочи кислотных оксидов (СО 2 ,SO 2 ,P 2 O 5 и др.) или водородных соединений (H 2 Sи др.), которым соответствуют многоосновные кислоты, на первом этапе при избытке щелочи всегда образуются средние соли, которые на втором этапе при наличии избытка поглощаемого реагента частично или полностью переходят в кислые соли:
СО 2 (газ) + 2 NaOH = Na 2 CO 3 + Н 2 О
Остаток углекислого газа реагирует с карбонатом натрия:
Na 2 CO 3 + СО 2 (газ) + Н 2 О = 2 NaHСО 3
|
окончание реакции: |
|
|
Итак, в растворе присутствует смесь солей: 0,1 моль NaHCO 3 и 0,2 моль Na 2 CO 3 .
Пример 2. В стакан с 200 мл раствора фосфорной кислоты с молярной концентрацией 0,5 моль/л внесли 6 г гидроксида натрия. Определите состав раствора после окончания реакции.
При нейтрализации щелочью (NaOH, KOH, NH 3 и др.) многоосновных кислот происходит последовательное замещение атомов водорода на металл или аммонийную группу и состав продуктов реакции зависит от соотношения количеств реагентов. В нашем случае, если – образуетсяNaH 2 PO 4 ; если 1: 2 , то Na 2 HPO 4 и если 1: 3 , то Na 3 PO 4 . В промежуточных вариантах возникает смесь солей.
Найдем
исходные количества реагентов:
; ,
– имеет место промежуточный вариант
между 1: 1 и 1: 2 , поэтому реакция идет в
два этапа:
,
– имеет место промежуточный вариант
между 1: 1 и 1: 2 , поэтому реакция идет в
два этапа:
H 3 PO 4 + NaOH = NaH 2 PO 4 + H 2 O
NaH 2 PO 4 + NaOH = Na 2 HPO 4 + H 2 O
Итак, в растворе после реакции присутствует смесь солей – по 0,05 моль NaH 2 PO 4 и Na 2 HPO 4 .
Успех в проведении расчетов по цепочкам химических уравнений в случае, когда продукт одной реакции является исходным веществом для другой, зависит от правильного выбора последовательности переходов от одного уравнения к другому. Выбрав согласно условию задачи опорное вещество, стрелками удобно указать последовательность расчета, помня при этом, что вещество, полученное в предыдущей реакции, в том же количестве используется в последующей если, естественно, в ходе всего многостадийного процесса нет потерь и выход каждой реакции 100 %.
Пример 3. Сколько литров хлора и водорода (н.у.) необходимо для получения хлороводорода, способного нейтрализовать раствор щелочи, образующийся при растворении в воде 13,7 г бария.
Составим уравнения всех реакций и стрелками укажем последовательность расчета:

Опорное вещество барий и его количество
(Ва) =
 .
.
Цепочка расчетов:
уравнение (I) - (Ba(OH) 2 /
I) = =>
=>
уравнение (II) - (HCl / II)=> уравнение (III) –
(Cl 2) =(H 2) = ,
,
тогда V(H 2) = V(Cl 2) = 0,1 моль· 22,4 л/моль = 2,24 л.
При решении задач на смеси веществ необходимо прежде всего для каждого компонента смеси отдельно записать все химические реакции, в которых он может участвовать в соответствии с условием задачи. В качестве опорных веществ обычно выбирают вещества исходной смеси и их количества (число молей) обозначают как неизвестные – x, y, z, …., а затем составляют уравнения материального баланса по количеству, массе или объему (для газов) участников химических реакций, где два последних необходимо выразить через неизвестные. Число балансовых уравнений должно быть равно числу неизвестных. На последнем этапе решается полученная система алгебраических уравнений.
Пример 4. При сгорании 13,44 л (н. у.) смеси водорода, метана и угарного газа образовалось 8,96 л углекислого газа и 14,4 г воды. Определить количества газов в смеси.
Уравнения реакций:
2H 2 + O 2 = 2H 2 O (I)
CH 4 + 2O 2 = CO 2 + 2H 2 O (II)
2CO + O 2 = 2CO 2 (III)
Опорные вещества – CH 4 , H 2 и CO; обозначим их количества
ν(H 2) = x; ν(СH 4) = y; ν(CO) = z.
Составим три балансовых уравнения по числу неизвестных:
а) баланс по объему смеси:
V (H 2) + V(CH 4) + V(CO) = 13,44 л, введем в него неизвестные:
xV m + yV m + zV m = 13,44 или x + y + z = 0,6
моль;
0,6
моль;
б) баланс по количеству CO 2:
ν(CO 2 / II) + ν(CO 2 / III) = ν общ. (CO 2), но
 ;
;
ν(CO 2 /
II) = ν(CH 4)
= y; ν(CO 2 /
III) =  z,
тогда
y + z = 0,4.
z,
тогда
y + z = 0,4.
в) баланс по количеству H 2 O:
ν(H 2 O/ I) + ν(H 2 O/ II) = ν общ. (H 2 O), но
 ,
,
 ;
; ,
,
тогда x + 2y = 0,8.
Итак, получаем систему уравнений вида
 ,
,
которая легко решается устно
x = 0,2 моль; y = 0,3 моль; z = 0,1 моль.
Методическая разработка урока (2 часа)
Расчёты по химическим уравнениям
Хапугина Полина Ивановна,
учитель химии ГБОУ СОШ 277
Кировского района Санкт-Петербурга
Цели урока: Научить восьмиклассников производить расчёты по химическим уравнениям: находить количество, массу и объём продуктов реакции по количеству, объёму и массе исходных веществ.
Ход урока:
Прежде чем перейти к изучению новой темы нам необходимо вспомнить уже известные вам величины и формулы. Вспомнить типы химических реакций. А также вы уже умеете составлять химические уравнения и уравнивать их. Давайте проверим ваши знания, для этого выполним следующий тест на оценку. (содержание теста можно посмотреть на моём личном сайте в папке файлы и фотографии)
Объяснение учителя:
1. Прежде чем научиться производить расчёты по химическим уравнениям необходимо ещё раз вспомнить уже известные нам формулы нахождения количество вещества, массы и объёма веществ, за одно вы сможете проверить себя, после выполненной вами работы. Для этого обратимся к следующей презентации, которая поможет восстановить наши знания в памяти. Презентация №1 .
Запишите уже известные вам формулы в тетрадь:
n- количество вещества (моль)
m- масса вещества (г)
М - молярная масса (г/моль)
V- объём газа (л)
V m - молярный объём = 22,4 л/моль
n = m/M ; m = n.M
n = V/V m ; V = n.V m
2. Теперь, мы должны понять, что химическое уравнение показывает не только качественную (превращение веществ) сторону процесса, но также и количественную сторону его. Для этого обратимся к следующей Презентации№2 (презентацию можно посмотреть на моём личном сайте в папке файлы и фотографии)
Запишите в тетрадь:
Коэффициент в уравнении реакции указывает на число частиц, а число частиц в свою очередь определяет количество молей!
2Н ₂ + О ₂ = 2Н ₂ О
Число частиц 2 молекулы 1 молекул 2 молекулы
Количество ↓ ↓ ↓
вещества, n 2 моль 1 моль 2 моль
2 Fe (OH )3 = Fe 2 O 3 + 3 H 2 O
↓ ↓ ↓
n = 2моль 1моль 3моль
3. Следующий этап, который мы должны разобрать - это умение составлять по уравнению реакции пропорцию, а также решить её. Для этого обратимся к следующей Презентации 3. (презентацию можно посмотреть на моём личном сайте в папке файлы и фотографии)
Запишите в тетрадь:
Известно по условию: 2 моль Х моль (числитель)
4P + 5O ₂ = 2P ₂ O ₅
Известно по уравнению: 4 моль 5 моль 2 моль (знаменатель)
Составим и решим пропорцию:
2 моль Х моль
_______ = _______
4 моль 2 моль
Х моль = 2 моль. 2 моль = 1 моль
4 моль
Х = n (P ₂ O ₅ )= 1 моль
4. Переходим к решению задач с использованием уравнений химических реакций. Для того чтобы решить расчетную задачу по химии, необходимо воспользоваться следующим алгоритмом - сделать пять шагов. Презентация 4. (презентацию можно посмотреть на моём личном сайте в папке файлы и фотографии) Учебник стр. 101
В тетрадь:
Учащимся раздаётся уже готовый алгоритм решения, для вклейки в тетрадь.
Алгоритм решения расчётных задач с использованием уравнением химических реакций:
1. Составить уравнение химической реакции(т.е. обязательно - расставить коэффициенты!)
2. Над соответствующими формулами в уравнении записать количественные данные о веществах с единицами измерения, которые известны или их можно рассчитать, исходя из условия задачи, и искомую величину Х также с единицами измерения.
3. Под этими формулами записать соответствующие количественные величины, задаваемые самим уравнением, также с единицами измерения.
4. Составить и решить пропорцию.
5. Оформить ответ.
5. Решим задачу.
Рассчитайте массу воды, которая образуется в результате взаимодействия 0,5 моль оксида алюминия с серной кислотой при нагревании.
Прочитайте задачу.
Запишите условие задачи. (Дано, найти.)
В тетрадь: (учащиеся записывают решение под объяснения учителя согласно Презентации 5 ) (презентацию можно посмотреть на моём личном сайте в папке файлы и фотографии)
Дано:
n(Al₂O₃)=0,5 моль
_________________
Найти:
Решение:
n =0,5 моль Х моль
Al ₂ O ₃ +3 H ₂ SO ₄ = Al ₂ (SO ₄ ) ₃ +3 H ₂ O
n = 1 моль 3 моль
М = 102 г/моль 18 г/моль
Расчет молекулярной массы:
Мr(Al₂O₃)= 2.27+3.16= 54+48=102
Мr(H₂O)= 2.1+16=18
Составить и решить пропорцию.
0,5 моль = Х моль
1 моль 3 моль
Х моль = n (H ₂ O ) = 0,5 моль. 3 моль = 1,5 моль
1 моль
Найдём массу воды.
m (H ₂ O ) = n (H ₂ O ) . M (H ₂ O )
m (H ₂ O ) = 1,5 моль.18 г/моль = 27 г
Ответ: m (H ₂ O )=27 г
6. Решите задачи самостоятельно.
Два учащихся вызываются к доске, для решения на оценку.
1. Определите объѐм хлора (н.у.), необходимый для получения 634 г хлорида алюминия по уравнению: 2Al + 3Cl 2 = 2AlCl 3 . Ответ: 159, 6 л
2. Рассчитайте количество вещества и массу лития, необходимого для реакции с кислородом массой 128 г по уравнению: 4Li + O 2 = 2Li 2 O Ответ: 16 моль, 112 г
7. Домашнее задание.
Задача.
Найти массу оксида цинка, который образуется при взаимодействии 13г цинка с кислородом.


 моль
моль моль
моль


 моль
моль моль
моль